
| A�� | ��X��Y��Z����Ԫ���γɵ�ij�ֻ�������ܺ������Ӽ� | |
| B�� | ����Ԫ�طֱ��γɵĵ��������У�M�����Ӱ뾶��� | |
| C�� | W���Ȼ�������һ��10e-���Ӻ�һ��18e-���ӹ��ɵ� | |
| D�� | XԪ����Z��������ĸ�Ԫ���γɵ�A2B�ͻ�������X2Z�е���� |
���� ԭ���������������X��Y��Z��M��WΪ���ֶ�����Ԫ�أ�X��Y�γɵ���̬�������ڱ�״���µ��ܶ�Ϊ0.76g•L-1�������̬���������Է�������=0.76��22.4=17��ӦΪNH3������֪XΪHԪ�ء�YΪNԪ�أ�X��Mͬ���壬Mԭ����������NԪ�أ���MΪNa��Y��Zͬ���ڣ�X��Z��M��Z�����Էֱ��γ�A2B��A2B2�͵Ļ������ZΪOԪ�أ�M��W�ֱ�ͬ���ڣ�X��Z��M��������֮�͵���Y��W��������֮�ͣ���M��Wԭ���������1+8-7=2������֪WΪAlԪ�أ�Y��M��W������������ˮ��������䶼�ܷ�����Ӧ���������⣬�Դ˽����⣮
��� �⣺XΪHԪ�ء�YΪNԪ�أ�ZΪOԪ�أ�MΪNa��WΪAlԪ�أ�
A��XΪHԪ�ء�YΪNԪ�أ�ZΪOԪ�أ�������Ǻ������Ӽ������ӻ������A��ȷ��
B�����Ӳ�ṹ��ͬ�˵����Խ��뾶ԽС�������Ƶ����Ӱ뾶���B��ȷ��
C���Ȼ�������һ��10e-�����Ӻ�һ��18e-�����ӹ��ɣ���C��ȷ��
D��ˮ���Ӽ��������е���ߣ���������ͣ���D����
��ѡD��
���� ���⿼��Ԫ���ƶϡ�Ԫ�������ɡ����ӽṹ��C��N��NaԪ�ػ��������ʵȣ�Ϊ��Ƶ���㣬������ѧ���ķ��������Ŀ��飬�Ѷ��еȣ������ܶ��ж�X��Y�γɵ���̬�������ǰ������ƶϵĹؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ϊ��ֹ�����⣬�������Ϳһ��������� | |
| B�� | Ϊ��ֹ���֣�����۳�������վ�ȳ���Ҫ�Ͻ��̻� | |
| C�� | Ϊ�ӿ�H2O2�ķֽ����ʣ��ѷ�Ӧ�����ŵ���ˮ����ȴ | |
| D�� | Ϊ�ӿ�KClO3�ķֽ����ʣ�����MnO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
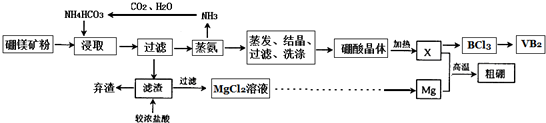
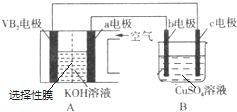
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���ȱ�������һ��ҩ���м��壬���ö��ȼױ�Ϊԭ�ϣ�ͨ����������������Ʊ�����Ӧ���£�
���ȱ�������һ��ҩ���м��壬���ö��ȼױ�Ϊԭ�ϣ�ͨ����������������Ʊ�����Ӧ���£�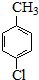 $��_{����}^{KMnO_{4}}$
$��_{����}^{KMnO_{4}}$
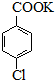 $\stackrel{H+}{��}$
$\stackrel{H+}{��}$
| �۵�/�� | �е�/�� | �ܶ�/g•cm��3 | ��ɫ | ˮ���� | |
| ���ȼױ� | 7.5 | 162 | 1.07 | ��ɫ | ���� |
| ���ȱ����� | 243 | 275 | 1.54 | ��ɫ | �� |
| ���ȱ������ | �����ε�ͨ�ԣ����ڿ������Σ��ܽ�����¶����߶����� | ||||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
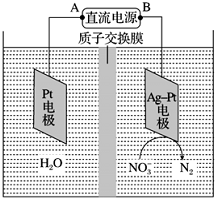 �绯ѧ����NO3-��ԭ����ͼ��ʾ��
�绯ѧ����NO3-��ԭ����ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ˮ��ȣ�AgCl��Na2CO3��Һ�е��ܽ�ȼ��ܶȻ������� | |
| B�� | ��Ӧ�����Һ�У�c��Na+����c��CO32-����c��Cl-��=c��Ag+����c��OH-����c��H+�� | |
| C�� | ��Һ��c��Cl-��=2��10-5mol•L-1 | |
| D�� | ����ת����Ӧ��2AgCl��s��+CO32-��aq��?Ag2CO3��s��+2Cl-��aq����ƽ�ⳣ��Ϊ2��10-9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ���� | 1 | 2 | 3 | 4 |
| ������mL�� | 19.22 | 19.18 | 19.80 | 19.20 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����Ԫ�غ�����ߵ����ķ���ʽCH4��
����Ԫ�غ�����ߵ����ķ���ʽCH4��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com