
下列有关化学用语的表示正确的是
 A.N2的电子式:
A.N2的电子式: B.CH4的比例模型:
B.CH4的比例模型:
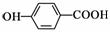
C.中子数为45的溴原子:45 35Br D.对羟基苯甲酸的结构简式:
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
如下图所示,利用海洋可提取很多重要的化工原料。
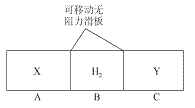

下列有关说法正确的是
第①步中除去粗盐中的SO42—、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:
Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.第②步中工业上可采用石墨为阴极,铁为阳极,采用阳离子交换膜的电解装置
C.第③步中结晶出的MgCl2·6H2O可在空气中受热分解制无水MgCl2
D.在第④步中溴元素被氧化,第⑤、⑥步中既有溴元素被氧化也有溴元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室里需用480 mL 0.1 mol·L-1的硫酸铜溶液,现选用500 mL容量瓶进行配制,以下操作正确的是( )
A.称取7.68 g硫酸铜,加入500 mL水
B.称取12.0 g胆矾,配成500 mL溶液
C.称取8.0 g硫酸铜,加入500 mL水
D.称取12.5 g胆矾,配成500 mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4 的混合气体1120mL (标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2 ︰1
B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L
C.NO2和N2O4 的混合气体中,NO2 的体积分数是80%
D.得到2.54沉淀时,加入NaOH溶液的体积是600mL
查看答案和解析>>
科目:高中化学 来源: 题型:
将15ml.2mol/LNa2CO3溶液逐滴加入到40 ml.0.5mol/LMCln盐溶液中,恰好将溶液中的Mn+离子完全沉淀为碳酸盐,则MCln中n值是 ( )
A.4 B.3 C.2 D.1
查看答案和解析>>
科目:高中化学 来源: 题型:
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:Ni(OH)2 + M NiOOH + MH 已知:6NiOOH + NH3 + H2O + OH-
NiOOH + MH 已知:6NiOOH + NH3 + H2O + OH- 6Ni(OH)2 + NO2-。下列说法正确的是( )
6Ni(OH)2 + NO2-。下列说法正确的是( )
A.NiMH 电池放电过程中,正极的电极反应式为:NiOOH + H2O + e- Ni(OH)2 + OH-
Ni(OH)2 + OH-
B.充电过程中OH-离子从阳极向阴极迁移
C.充电过程中阴极的电极反应式:H2O + M + e- MH + OH-,H2O中的H被M还原
MH + OH-,H2O中的H被M还原
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,下列叙述正确的是 ( )
A.pH=2的HA酸溶液与pH=12的MOH碱溶液以任意比混合:
c(H+) + c(M+)=c(OH-) + c(A-)
B.将物质的量浓度均为0.1mol·L−1的Na2CO3溶液、NaHCO3溶液等体积混合所得溶液中:2c(OH−)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32−)
C.等浓度、等体积的Na2CO3和NaHCO3混合: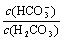 <
<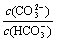
D.将足量AgCl分别放入:①5m水②10mL0.2mol/LMgC12③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列).该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是( )
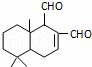
|
| A. | Br2的CCl4溶液 | B. | Ag(NH3)2OH溶液 | C. | HBr | D. | H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
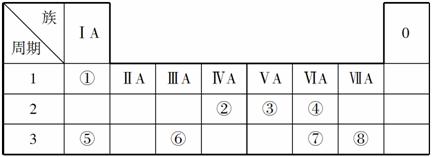
(1)请画出元素⑥的离子结构示意图:________。
(2)元素⑦中质子数和中子数相等的同位素符号是____________。
(3)④⑤⑦的简单离子半径由大到小的顺序为____________。
(4)②的最高价氧化物对应水化物的电离方程式为__________________。
(5)④⑤两种元素的原子按1:1组成的常见化合物的电子式为________。
(6)由表中两种元素形成的5核10电子分子常做燃料电池的燃料,该电池在碱性条件下的负极反应式为____________________。
(7)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂。已知16 g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838 kJ热量,写出A与B反应的热化学方程式________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com