
【题目】C是组成细胞的最基本元素,最可能的原因是
A. 含量最高 B. 含量最稳定
C. 分布最广泛 D. 构成有机物的基本骨架
科目:高中化学 来源: 题型:
【题目】中国第25次南极科考队在南极进行了为期5个月的科学考察,科考队在南极发现了大量奇异的新物种,那么在它们体内最基本的化学元素和含量最多的化学元素是
A. C和O B. O和C C. C和N D. O和H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一套制取并验证氯气部分化学性质的实验装置.

回答下列问题:反应的方程式:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)装置A中,仪器a的名称叫 ,该仪器中盛有的试剂为 .
(2)当Cl2气流通过一段时间后,装置B中溶液的pH值 7(填“>”“<”或“=”),写出Cl2与水反应的方程式
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为 色,反应的离子方程式为 .
(4)当Cl2气流持续通过时,装置D中干燥的有色布条能否褪色?为什么? .
(5)装置E的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下:
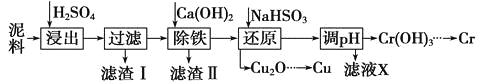
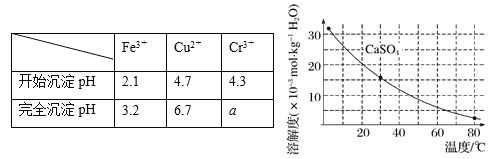
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有 。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH范围 ,检验Fe3+已经除尽的操作是 ;
②将浊液加热到80℃, 。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式: ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是 。
(4)当离子浓度小于或等于1×10-5 mol·L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH-)≥ 。[已知:Ksp[Cr(OH)3] = 6.3×10-31,![]() ≈4.0]。
≈4.0]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利尿酸在奥运会上被禁用,其结构简式如下图所示。下列叙述正确的是( )

A. 利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4
B. 利尿酸分子内处于同一平面的原子不超过10个
C. 1 mol利尿酸能与7 mol H2发生加成反应
D. 利尿酸能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g) + I2(g)![]() 2HI(g) ΔH=-a kJ·mol-1
2HI(g) ΔH=-a kJ·mol-1
已知: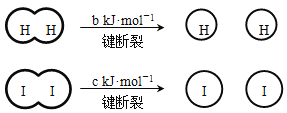 (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
A.反应物的总能量高于生成物的总能量
B.断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量
C.断开2 mol H-I键所需能量约为(c+b+a) kJ
D.向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究所对含硫酸亚铁和硫酸铜的工业废料进行相关的研究。实验过程如下:
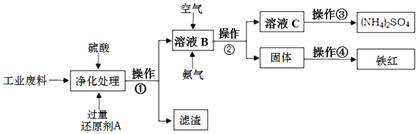
回答下列问题:
(1)滤渣的成分为____________,操作①的名称为____________。
(2)上图溶液B中所发生反应的离子方程式为__________________。
(3)实验要求向溶液B中通入过量的空气,证明通入空气过量的方法是___________。
(4)操作③第一步需要的仪器除了酒精灯、铁架台外,还需要_________________。
(5)某同学利用下面装置制备氢气并利用氢气还原某金属氧化物,根据要求回答问题。

①请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是A→_________________→D(除D装置外,其它装置不能重复使用),最后D装置中所加药品为____________,其作用是______。
②点燃B处酒精灯之前必须进行的操作是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某届奥运会上,有个别运动员因服用兴奋剂被取消参赛的资格。下图是检测出兴奋剂的某种同系物X的结构,关于X的说法正确的是( )

A.X分子中不可能所有原子都在同一平面上
B.X 遇到FeCl3溶液时显紫色,而且能使溴的四氯化碳溶液褪色
C.1 mol X 与足量的浓溴水反应,最多消耗5 mol Br2
D.1 mol X在一定条件下与足量的氢气反应,最多消耗1 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的化学变化乍看起来,好像十分复杂,难以把握,而实际上是有规律可循的。认识化学原理并将化学原理应用于实际正是化学的魅力所在。
I.在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示
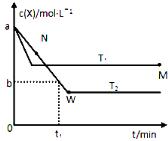
①该反应的化学平衡常数表达式为:_____________
②M点的正反应速率v正_________(填“>”、“=”或“<”)N点的逆反应速率v逆;T2下,在0~t1时间内,v(Y)=_______________;该反应进行到M点放出的热量_________(填“>”、“=”或“<”)进行到W点放出的热量。
③M点时再加入一定量的X,平衡后X的转化率___________(填“增大”、“减小”或“不变”)
II.0.1mol/LNaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中离子浓度由大到小的顺序为_________________
III.下图是某种燃料电池原理示意图:
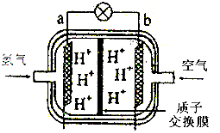
(1)该燃料电池工作过程中,其正极反应式为:________________________。
(2)若用此燃料电池作为电源向铁制品上镀上一层铜,则铁制品要连接在燃料电池的__________极(填“a”或“b”)上.若用此燃料电池电解精炼银,应使粗银作电解池的____________极,使用AgNO3和HNO3的混合溶液作电解液,若阴极有少量红棕色气体生成,则生成该气体的电极反应式为:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com