
| A. | v(B)=0.25 mol•L-1•s-1 | B. | C的体积分数为30% | ||
| C. | B的转化率为25% | D. | n=2 |
分析 将3mol A与3mol B混合于3L的密闭容器中,2s后达平衡A的转化率为50%,则转化的A为3mol×50%=1.5mol,则:
2A(g)+3B(g)?2C(g)+nD(g)
起始量(mol):3 3 0 0
转化量(mol):1.5 2.25 1.5 0.75n
平衡量(mol):1.5 0.75 1.5 0.75n
A.根据v=$\frac{△c(B)}{△t}$计算v(B);
B.结合D的反应速率计算n的值,C的体积分数=$\frac{C的物质的量}{混合气体总物质的量}$;
C.B的转化率=$\frac{转化的B的物质的量}{B的起始物质的量}$×100%;
D.结合D的反应速率计算n的值.
解答 解:将3mol A与3mol B混合于3L的密闭容器中,2s后达平衡A的转化率为50%,则转化的A为3mol×50%=1.5mol,则:
2A(g)+3B(g)?2C(g)+nD(g)
起始量(mol):3 3 0 0
转化量(mol):1.5 2.25 1.5 0.75n
平衡量(mol):1.5 0.75 1.5 0.75n
A.v(B)=$\frac{\frac{2.25mol}{3L}}{2s}$=0.375mol/(L.s),故A错误;
B.v(D)=0.25mol•L-1•s-1,则0.75n mol=v(D)=0.25mol•L-1•s-1×2s×3L,解得n=2,C的体积分数=$\frac{1.5mol}{5.25mol}$=28.6%,故B错误;
C.B的转化率=$\frac{2.25mol}{3mol}$×100%=75%,故C错误;
D.v(D)=0.25mol•L-1•s-1,则0.75n mol=v(D)=0.25mol•L-1•s-1×2s×3L,解得n=2,故D正确,
故选:D.
点评 本题考查化学平衡计算、反应速率计算,难度不大,注意三段式解题法在化学平衡计算中应用.


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁和稀硝酸反应 | B. | 氢氧化钡和稀盐酸反应 | ||
| C. | 氢氧化钾溶液中通入硫化氢气体 | D. | 氢氧化钡溶液和稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| T/℃ | 25 | 80 | 230 |
| K | 5×104 | 1 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
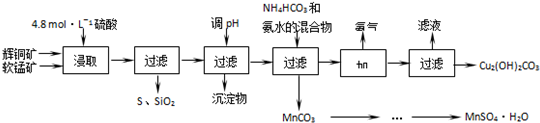
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 4 3 2 2 6 | B. | 0 2 1 0 1 2 | ||
| C. | 2 0 1 2 0 2 | D. | 2 2 2 2 1 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加过程中水的电离程度始终增大 | |
| B. | 当加入10mL NH3•H2O时,c(NH${\;}_{4}^{+}$)<c(HCOO-) | |
| C. | 当两者恰好中和时,溶液pH=7 | |
| D. | 滴加过程中c(HCOOH)与c(HCOO-)之和保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com