
【题目】大气中CO2含量的增多除了导致地球表面温度升高外,还会影响海洋生态环境。某研究小组在实验室测得不同温度下(T1,T2)海水中CO32-浓度与模拟空气中CO2浓度的关系曲线。已知:海水中存在以下平衡:CO2(aq)+CO32-(aq)+H2O(aq)![]() 2HCO3-(aq),下列说法不正确的是
2HCO3-(aq),下列说法不正确的是
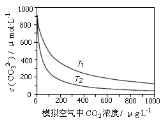
A.T1>T2
B.海水温度一定时,大气中CO2浓度增加,海水中溶解的CO2随之增大,CO32-浓度降低
C.当大气中CO2浓度确定时,海水温度越高,CO32- 浓度越低
D.大气中CO2含量增加时,海水中的珊瑚礁将逐渐溶解
【答案】C
【解析】
题中给出的图,涉及模拟空气中CO2浓度以及温度两个变量,类似于恒温线或恒压线的图像,因此,在分析此图时采用“控制变量”的方法进行分析。判断温度的大小关系,一方面将模拟空气中CO2浓度固定在某个值,另一方面也要注意升高温度可以使![]() 分解,即让反应
分解,即让反应![]() 逆向移动。
逆向移动。
A.升高温度可以使![]() 分解,反应
分解,反应![]() 逆向移动,海水中的
逆向移动,海水中的![]() 浓度增加;当模拟空气中CO2浓度固定时,T1温度下的海水中
浓度增加;当模拟空气中CO2浓度固定时,T1温度下的海水中![]() 浓度更高,所以T1温度更高,A项正确;
浓度更高,所以T1温度更高,A项正确;
B.假设海水温度为T1,观察图像可知,随着模拟空气中CO2浓度增加,海水中的![]() 浓度下降,这是因为更多的CO2溶解在海水中导致反应
浓度下降,这是因为更多的CO2溶解在海水中导致反应![]() 正向移动,从而使
正向移动,从而使![]() 浓度下降,B项正确;
浓度下降,B项正确;
C.结合A的分析可知,大气中CO2浓度一定时,温度越高,海水中的![]() 浓度也越大,C项错误;
浓度也越大,C项错误;
D.结合B项分析可知,大气中的CO2含量增加,会导致海水中的![]() 浓度下降;珊瑚礁的主要成分是CaCO3,CaCO3的溶解平衡方程式为:
浓度下降;珊瑚礁的主要成分是CaCO3,CaCO3的溶解平衡方程式为:![]() ,若海水中的
,若海水中的![]() 浓度下降会导致珊瑚礁中的CaCO3溶解平衡正向移动,珊瑚礁会逐渐溶解,D项正确;
浓度下降会导致珊瑚礁中的CaCO3溶解平衡正向移动,珊瑚礁会逐渐溶解,D项正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】亚硝酸盐与钴(Ⅲ)形成的一种配合物1Co(NH3)5NO2]Cl2的制备流程如下:
![]()
(1)Co2+基态核外电子排布式为 。
(2)配合物1Co(NH3)5Cl]Cl2中与Co3+形成配位键的原子为 (填元素符号);配离子 1Co(NH3)5NO2]2+的配体中氮原子的杂化轨道类型为 。
(3)与NO2-互为等电子体的单质分子为 (写化学式)。
(4)H2O2与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为 。
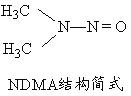
(5)亚硝酸盐在水体中可转化为强致癌物亚硝胺,亚硝胺NDMA的结构简式如图所示,1molNDMA分子中含有![]() 键的数目为 mol。
键的数目为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。填写下列空白:
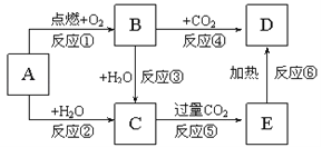
![]() 写出化学式:B__________,C______________,D __________________
写出化学式:B__________,C______________,D __________________
![]() 写出反应
写出反应![]() 的离子方程式:_______________________________________
的离子方程式:_______________________________________
![]() 写出反应
写出反应![]() 的化学反应方程式:_________________________________
的化学反应方程式:_________________________________
![]() 写出反应
写出反应![]() 的化学反应方程式,______________,若产生
的化学反应方程式,______________,若产生![]() 氧化产物,被还原的物质是__________,其物质的量是____mol,转移的电子数目______
氧化产物,被还原的物质是__________,其物质的量是____mol,转移的电子数目______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意完成下列填空。
(1)a.金刚石和石墨 b.12C和13C c.CH4和C2H6 d.乙醇与二甲醚(填字母)
①互为同位素的是___;
②互为同素异形体的是___;
③互为同系物的是___;
④互为同分异构体的是___。
(2)请补充完下列方程式:
①CH4+Cl2![]() ___+HCl
___+HCl
②CH2=CH2+Br2→___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)⑧的原子结构示意图为_________;
(2)②的气态氢化物分子的结构式为___________,②和⑦的气态氢化物的稳定性相比,其中较弱的是____ (用该氢化物的化学式表示);
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是____(填化学式);
(4)⑤、⑥元素的金属性强弱依次为___________(填“增大”、“减小”或“不变”);
(5)④、⑤、⑥的形成的简单离子半径依次_________(填“增大”、“减小”或“不变”);
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】缓冲溶液可以抗御少量酸碱对溶液pH的影响。人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系(H2CO3/HCO3-),维持血液的pH保持稳定。己知在人体正常体温时,反应H2CO3![]() HCO3-+H+的Ka=10-6.1 ,正常人的血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3。则下列判断正确的是
HCO3-+H+的Ka=10-6.1 ,正常人的血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3。则下列判断正确的是
A.正常人血液内Kw=10-14
B.由题给数据可算得正常人血液的pH约为7.4
C.正常人血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3)
D.当过量的碱进入血液中时,只有发生HCO3-+OH-=CO32-+H2O的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下,下列说法错误的是( )
实验 序号 | 实验温度T/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间t/s | ||||
KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 4 | 0.02 | 6 | 0.1 | 0 | 6 |
B | 293 | 4 | 0.02 | 4 | 0.1 | V1 | 8 |
C | T1 | 4 | 0.02 | 6 | 0.1 | 0 | 5 |
A.时间t的意义是,从溶液混合到KMnO4颜色褪去的时间
B.实验C中5s内平均反应速率v(KMnO4)=1.6×10-3molL-1s-1
C.实验A和B是探究
D.实验A和C是探究温度对反应速率的影响,则T1>293
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在化工生产中有着广泛的应用。
I.为解决大气中CO2的含量增大的问题,某科学家提出如下构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,在合成塔中经化学反应使废气中的CO2转变为燃料甲醇。部分技术流程如下:
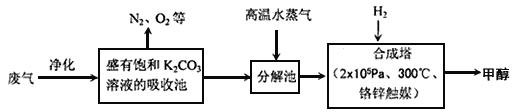
⑴合成塔中反应的化学方程式为_________;△H<0。该反应为可逆反应,从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考虑温度对反应速率的影响外,还主要考虑了_____。
(2)从合成塔分离出甲醇的原理与下列_______操作的原理比较相符(填字母)
A.过滤 B.分液 C.蒸馏 D.结晶
(3)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。写出CO2(g)与H2(g)反应生CH4(g)与液态水的热化学方程式_____。
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=-890.3kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ/mol
II.某兴趣小组模拟工业合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO和2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO和2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/Mpa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
(1)从反应开始到20min时,以CO表示反应速率为________。
(2)下列描述能说明反应达到平衡的是_______
A.装置内气体颜色不再改变 B.容器内气体的平均摩尔质量保持不变
C.容器内气体的压强保持不变 D.容器内气体密度保持不变
(3)该温度下平衡常数K=_______,若达到平衡后加入少量CH3OH(g),此时平衡常数K值将_________ (填“增大”、“减小”或“不变”)
(4)该反应达到平衡后,再向容器中充入1mol CO和2mol H2,此时CO的转化率将_____(填“增大”、“减小”或“不变”)
Ⅲ. 人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:
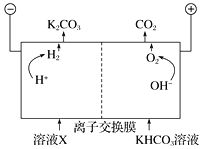
①在阳极区发生的反应包括_________和H++HCO![]() ===H2O+CO2↑。
===H2O+CO2↑。
②简述CO32-在阴极区再生的原理:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种重要的有机物,可通过以下方法合成:

(1)B中含有的官能团名称为_________________。
(2)A→B的化学方程式为_________________。
(3)B→C的反应类型为_________________。
(4)E的分子式为C10H10O4N2,写出E的结构简式:______________________。
(5)写出同时满足下列条件的C的一种同分异构体的结构简式:_______________________。
①能发生银镜反应;②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;
③分子中只有4种不同化学环境的氢。
(6)已知:CH3CHO+CH3CHO![]() CH3CH=CHCHO。请结合题给信息,以苯和
CH3CH=CHCHO。请结合题给信息,以苯和![]() 为原料制备
为原料制备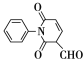 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)__________________。
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com