
【题目】制取Fe(OH)2并使之能久存,可采取的操作有:①加入一些植物油;②溶解FeSO4配成溶液;③把蒸馏水加热煮沸,并密封冷却;④加入少量铁屑;⑤向FeSO4溶液中滴加足量氨水;⑥把盛有氨水的胶头滴管伸入FeSO4溶液中后再挤出氨水。进行操作的正确顺序是
A.③②⑤④B.③②④①⑥C.③②④⑥D.②④①⑥
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】某含C、H、O三种元素的未知物M的相对分子质量小于100,经燃烧分析实验测定该未知物碳的质量分数为40%,氢的质量分数为6.7%。由此所得结论正确的是
A. M的分子式为CH2O B. M的实验式为CH30
C. M不可能是2-羟基丙酸 D. M可能是饱和一元羧酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁在潮湿空气中发生电化腐蚀时,正极发生的主要反应是( )
A. Fe-2e-=Fe2+B. 2H++2e-=H2C. 4OH --4e-=2H2O+O2D. 2H2O+O2+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向溶液M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示。则下列分析与判断不正确的是(不计CO2溶解)

A. 若OB=0,则形成溶液的过程中所发生反应的离子方程式为OH―+CO2═HCO3―
B. 若OB=BC,则溶液M为Na2CO3溶液
C. 若OB>BC,则溶液M中大量存在的阴离子为CO32―和HCO3―
D. 若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Mg、Al混合物投入200mL某浓度的盐酸中,金属完全溶解后,再逐滴加入2mol L-1的NaOH溶液至过量,所生成的沉淀与所加NaOH的关系如图所示。
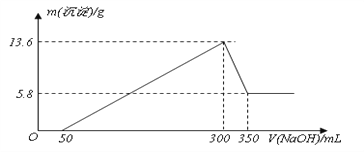
(1)0~50mL段内,发生反应的离子方程式为_________________。
(2)300~350mL段内,发生反应的离子方程式为________________。
(3)试计算该盐酸的浓度___。(写出必要的计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,几种物质的pH和浓度如下表所示。
序号 | ① | ② | ③ | ④ |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
pH | 11 | 11 | 3 | 3 |
浓度 | c1 | c2 | c3 | c4 |
回答下列问题:
(1) c1_____(填“>”“<”或“=”) c2。
(2)溶液中水的电离程度②_____(填“>”“<”或“=”)③。
(3)分别加水稀释10倍,稀释后四种溶液的pH由大到小的顺序为________(填序号)。
(4) ①溶液与④溶液等体积混合,溶液的pH_______(填“>"'<"或“=”,下同)7,混合溶液中c(NH4+)____c(Cl-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语不正确的是( )
A. 质子数为8、中子数为10的氧原子:![]()
B. 比例模型![]() , 不能表示二氧化碳,可以表示水分子
, 不能表示二氧化碳,可以表示水分子
C. 碳正离子(CH3+)的电子式为 ![]()
D. 氨气溶于水使溶液呈碱性:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4+ + OH-
NH4+ + OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是用0.1mol/LNaOH溶液分别滴定20mL浓度均为0.1mol/L的不同一元酸的滴定曲线,下列说法错误的是( )
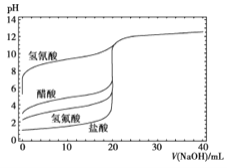
A.酸性:HF>CH3COOH>HCN
B.用NaOH溶液滴定醋酸时,应用酚酞作指示剂不能使用甲基橙
C.当加入10mLNaOH溶液时,c(CN-)>c(CH3COO-)
D.随NaOH溶液的滴入,CH3COOH溶液中水的电离程度先变大后变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com