
| A、0.1 mol?L-1的NaHCO3 溶液中含有Na+的数目为0.1NA |
| B、标准状况下,1mol苯含有C=C 双键的数目为3NA |
| C、常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA |
| D、标准状况下,22.4L NO2与水充分反应转移的电子数目为0.1NA |
| 2 |
| 3 |
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| 2 |
| 3 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
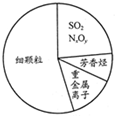
| A、大量燃烧化石燃料是造成雾霾天气的一种重要因素 |
| B、重金属离子可导致蛋白质变性 |
| C、SO2和NxOy均属于酸性氧化物 |
| D、苯是最简单的芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入一定量的M |
| B、加入一定量的不与M、N、P、Q反应的气体 |
| C、反应温度升高 |
| D、加入某物质作催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、a为负极,b为正极 |
| B、若a极是铁,b极是铜,b极逐渐溶解,a极上有铜析出 |
| C、若a、b极都是石墨,在相同条件下,理论上a极产生的气体与电池中消耗的O2体积相等 |
| D、若电解精炼粗铜时,b极是粗铜,a极是纯铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 通电 |
| A、电池工作时,锌失去电子 |
| B、电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq) |
| C、电池工作时,电子由正极通过外电路流向负极 |
| D、外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1g氢气中所含有的分子数为NA |
| B、0.5mol/L的AlCl3溶液中含有氯离子数为1.5NA |
| C、27g铝与足量NaOH反应消耗OH-的数目为4NA |
| D、7.8g的Na2O2与水完全反应转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 | (此处不要求填写) |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式
有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com