
【题目】为了检验某固体物质中是否含有NH4+,一定用不到的试剂或试纸是
A. NaOH溶液 B. 浓盐酸 C. 稀硫酸 D. 红色石蕊试纸
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在标况下,m g气体A与n g气体B的分子数目一样多,以下说法不正确的是( )
A.在任意条件下,若两种分子保持原组成,则其相对分子质量之比为m:n
B.25℃,1.25×105 Pa时,两气体的密度之比为n:m
C.同质量的A,B在非标准状况下,其分子数之比为n:m
D.相同状况下,同体积的气体A与B的质量之比为m:n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其实验的装置如下(反应需要加热,图中省去了加热装罝):
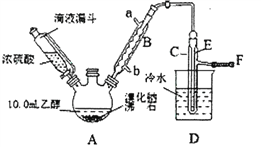
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红色液体 |
密度/(g cm-3) | 0.79 | 1.44 | 3. 1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)A装置的名称是________。
(2)沸石的作用是________。
(3)己知H2SO4(浓)+NaBr![]() NaHSO4+HBr↑,写出A中生成溴乙烷的化学方程式________。
NaHSO4+HBr↑,写出A中生成溴乙烷的化学方程式________。
(4)C中收集到的粗产品混有杂质的主要成份是________;为了除去这些杂质,最好选择下列____(选填序号)溶液来洗涤所得粗产品。
A.氢氧化钠B.碘化钠C.亚硫酸钠D.碳酸氢钠
(5)粗产品洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的M固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g。
①M固体的名称为________;
②在上述提纯过程中每次分液时,产品均从分液漏斗的________(填“上口”或“下口”)放出;
③从乙醇的角度考虑,本实验所得溴乙烷的产率是_________。
(6)该实验装罝的主要缺陷是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH=13的某溶液中存在大量的Na+、ClO-、NO3-,该溶液还可能大量存在的离子是
A. NH4+B. HCO3-C. SO42-D. Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:周期表中前四周期的六种元素A、B、C、D、E、F核电荷数依次增大,其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F2+离子核外各层电子均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为____。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点高,理由是____________________。
(3)E的最高价氧化物分子的空间构型是__________,是____分子(填“极性”“非极性”)。
(4)F原子的核外电子排布式是________________。
(5)E、F形成某种化合物有如图所示两种晶体结构(深色球表示F原子),其化学式为_________。(a)中E原子的配位数为____。若在(b)的结构中取出一个平行六面体作为晶胞,则平均一个晶胞中含有____个F原子。结构(a)与(b)中晶胞的原子空间利用率相比,(a)____(b)(填“>”“<”或“=”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种光化学电池的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)===Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )
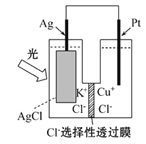
A. Cl-由负极迁移到正极
B. 负极上物质发生还原反应
C. Cu+在负极发生氧化反应
D. 生成108 g银,转移电子个数为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期元素,其中X元素原子的核外电子总数等于其电子层数, X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水, Z元素是地壳中含量最高的金属元素,W 的原子半径是第三周期中最小的。
(1)写出YX4+的电子式_______。
(2)写出Z与W所形成的盐与 YX3的水溶液反应的离子方程式________________。
(3)室温下,pH=3的XW溶液与pH=5的YX4W溶液中由水电离出的c(H+)的比为___。
(4)已知X单质和Y单质反应生成YX3的反应是可逆反应,ΔH<0, 将X、Y的两种单质以等物质的量充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的是_____________________。
a.达到化学平衡时,任何一种物质表示的正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,X、Y两种单质在混合气体中的物质的量之比为1∶1
d.达到化学平衡的过程中混合气体的平均相对分子质量减小
(5)有人设想寻求合适的催化剂和电极材料,以Y2、X2为电极反应物,以XW-YX4W 为电解质溶液制备新型燃料电池。请写出该电池的正极反应式_____________。
(6)汽车尾气中含有CO、NO、NO2等有毒气体,对汽车加装尾气净化装置,用含铂等过渡元素的催化剂催化,可使有毒气体相互反应转化成无毒气体。
已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+68 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221 kJ·mol-1
C(s)+O2(g)=CO2 (g) ΔH3=-393.5 kJ·mol-1
CO与NO2反应的热化学方程式为____________________,反应一定条件下可逆,温度不同(T2>T1二者均大于常温)、其他条件相同,下列图像正确的是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d是四种短周期元素,a、b、c同周期,c、d同主族.a的原子结构示意图为 ![]() ,b与d形成的化合物的电子式为
,b与d形成的化合物的电子式为 ![]() ,则下列叙述中正确的是( )
,则下列叙述中正确的是( )
A.原子序数:a>b>c
B.d单质最活泼
C.原子半径:a>c>d
D.最高价氧化物对应的水化物的酸性:d>a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组的同学拟用下图所示的装置从含碘废液(除H2O外,还有I2、I-等)中回收碘。回答下列问题:

(1)装置A中发生反应的离子方程式为________。
(2)仪器X的名称为________;装置D的作用是________。
(3)装置C中球形冷凝管冷却水从________(填“a”或“b”)进入,反应控制在较低温度下且保持溶液pH =2进行,其主要原因是________。
(4)三口烧瓶中液体经过滤得粗碘,粗碘可经________(填操作名称)得到纯碘。
(5)为测定某含碘废水中I2的含量,取样l00mL,调节溶液pH后,滴加2滴淀粉溶液,然后用0.02500mol/LNa2S2O3标准溶液滴定,消耗标准液18.15mL。则滴定终点时的现象为________,含碘废水中I2的含量=________mg/mL(结果保留小数点后三位,已知:I2 +2S2O32-=2I-+S4O62-)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com