
| A.氧化性Cr2O72->Fe3+>SO2 |
| B.Cr2O72-能将Na2SO3氧化成Na2SO4 |
| C.若33.6 L SO2(标准状况)参加反应,则最终消耗K2Cr2O7 0.5 mol |
| D.反应中Fe2(SO4)3既是氧化剂,又是还原剂 |
科目:高中化学 来源:不详 题型:单选题
| A.①②⑤ | B.②③④ | C.①②⑥ | D.②③⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.用淀粉—KI试纸和食醋检验加碘盐时淀粉—KI试纸会变蓝 |
| B.足量Cl2能使湿润的、已变蓝的淀粉—KI试纸退色的原因可能是5Cl2+I2+6H2O=2HIO3+10HCl |
| C.由图可知氧化性的强弱顺序为Cl2>I2>IO3- |
| D.途径Ⅱ中若生成1 mol I2,则反应中转移的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定有碘离子 | B.可能含铁离子 |
| C.可能有氯离子 | D.不含硝酸根离子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 FeCl3
FeCl3 FeI3
FeI3 FeSO4+Cu
FeSO4+Cu CuCl2+FeCl2
CuCl2+FeCl2 FeCl2+Br2
FeCl2+Br2 FeBr3+I2
FeBr3+I2查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A. | B. | C. | D. |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 操 作 | 现 象 | 结 论 |
| A | 向溶液X中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 溶液X中无NH |
| B | 将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,向上层溶液中滴加KSCN溶液 | 上层溶液不变红, 下层溶液紫红色 | 氧化性:Br2>Fe3+>I2 |
| C | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| D | 向漂白粉上加入较浓的盐酸,将湿润淀粉碘化钾试纸置于试管口 | 产生气泡,试纸未变蓝 | 漂白粉已经失效 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
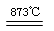 Cl2+2KIO3,下列说法正确的是
Cl2+2KIO3,下列说法正确的是| A.向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀 |
| B.反应过程中I2置换出Cl2,由此可推断非金属性I>CI |
| C.KClO3和KIO3均属于离子化合物,都只含有离子键 |
| D.制备KIO3的反应中氯元素被还原 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 MnCl2 + Cl2+2H2O 判断以下各组物质的氧化性由强到弱顺序正确的是
MnCl2 + Cl2+2H2O 判断以下各组物质的氧化性由强到弱顺序正确的是| A.MnO2、FeCl3、Cl2、CuCl2 | B.Cl2、FeCl3、MnO2、CuCl2 |
| C.MnO2、Cl2、FeCl3、CuCl2 | D.CuCl2、FeCl3、Cl2、MnO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com