
| A. | SO2和Cl2混合通入水中后可能使品红褪色 | |
| B. | 二氧化硫的排放会导致光化学烟雾和酸雨的产生 | |
| C. | 单质硫在自然界只以化合态存在 | |
| D. | 浓硫酸可用来干燥SO2、CO、Cl2等气体 |
分析 A.SO2和Cl2混合通入水中生成盐酸和硫酸;
B.二氧化硫的排放会导致酸雨;
C.火山口存在游离态的硫;
D.浓硫酸具有酸性和强氧化性,只能用于干燥酸性、中性且与浓硫酸不发生氧化还原反应的气体.
解答 解:A.SO2和Cl2混合通入水中发生氧化还原反应生成盐酸和硫酸,都不具有漂白性,故A错误;
B.二氧化硫导致酸雨,氮氧化物导致光化学烟雾,故B错误;
C.自然界中存在游离态的硫,如火山口存在游离态的硫,故C错误;
D.SO2、Cl2等为酸性气体,CO为中性气体,且都与浓硫酸不发生氧化还原反应,可用浓硫酸来干燥,故D正确.
故选D.
点评 本题考查含硫物质的性质,侧重二氧化硫、浓硫酸性质的考查,注意性质与现象、用途的关系即可解答,注重基础知识的训练,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
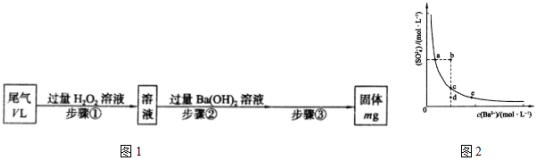
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
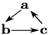 (“→”表示反应一步完成)关系转化的是( )
(“→”表示反应一步完成)关系转化的是( )| 选项 | a | b | c |
| A | NO | NO2 | HNO3 |
| B | SiO2 | Na2SiO3 | H2SiO3 |
| C | Al | NaAlO2 | Al(OH)3 |
| D | MgCl2 | Mg(OH)2 | MgO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L水中含有1 mol H2SO4 | |
| B. | 1 L溶液中含有1 mol H+ | |
| C. | 将98 g H2SO4溶于1 L水中配成溶液 | |
| D. | 1 L H2SO4溶液中含98 g H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
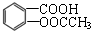 是一种常用的退热、镇痛药物,临床常用于预防心血管疾病.阿斯匹林对肠胃有一定的副作用,患有消化系统疾病的人不宜服用.则下列对此化合物说法不正确的是( )
是一种常用的退热、镇痛药物,临床常用于预防心血管疾病.阿斯匹林对肠胃有一定的副作用,患有消化系统疾病的人不宜服用.则下列对此化合物说法不正确的是( )| A. | 阿斯匹林能与NaHCO3反应,最多能与3mol H2发生加成反应 | |
| B. | 1 mol阿斯匹林与足量的NaOH溶液反应,消耗NaOH最大的物质的量为3 mol | |
| C. | 其苯环上的一氯取代物有两种 | |
| D. | 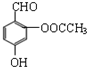 与阿斯匹林互为同分异构体,该有机物遇FeCl3溶液显紫色 与阿斯匹林互为同分异构体,该有机物遇FeCl3溶液显紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-、NO3- | B. | Na+、Cl- | C. | Na+、NO3- | D. | Cl-、Na+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液溴保存过程中,应在其液面上加少量水进行液封 | |
| B. | 少量的碱金属单质均应保存在煤油中 | |
| C. | FeCl3溶液存放时应加少量盐酸 | |
| D. | AgNO3溶液和KMnO4溶液均应存放在棕色试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com