
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.分析 (1)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的和缺少的仪器;
(2)依据C=$\frac{1000ρω}{M}$计算浓硫酸物质的量浓度,根据溶液稀释定律C浓V浓=C稀V稀来计算;根据“大而近”的原则,根据需要量取的浓硫酸的体积来选择合适的量筒;
(3)根据c=$\frac{n}{V}$分析,操作对溶质的物质的量或对溶液的体积的影响.
解答 解:(1)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有玻璃棒、烧杯、胶头滴管、量筒和100mL容量瓶,用不到的仪器:烧瓶、托盘天平;还缺少的仪器:100mL容量瓶、玻璃棒;
故答案为:②④;100mL容量瓶、玻璃棒;
(2)浓硫酸物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要的浓硫酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:18.4mol/L×VmL=1mol/L×100mL,解得V=5.4mL;根据“大而近”的原则,根据需要量取的浓硫酸的体积为5.4mL故应选择10mL的量筒;
故答案为:①;
(3)A.向容量瓶中转称溶液时(实验步骤②)不慎有液滴洒在容量瓶外面,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故A选;
B.加蒸馏水时不慎超过了刻度线,导致溶液体积偏大,溶液浓度偏低,故B选;
C.定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故C不选;
D.配制前,容量瓶中有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故D不选;
故选:AB.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,明确配制原理及操作步骤是解题关键,属于基础型题目,难度不大,注意容量瓶、量筒规格选择及使用方法.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:解答题
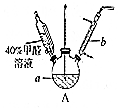 甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发.为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究.
甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发.为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究.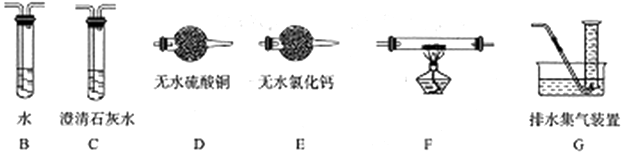
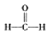 $\stackrel{被氧化}{→}$
$\stackrel{被氧化}{→}$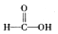 $\stackrel{被氧化}{→}$
$\stackrel{被氧化}{→}$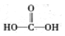 .设计实验证明a中甲醛的碳元素未被氧化成+4价.
.设计实验证明a中甲醛的碳元素未被氧化成+4价.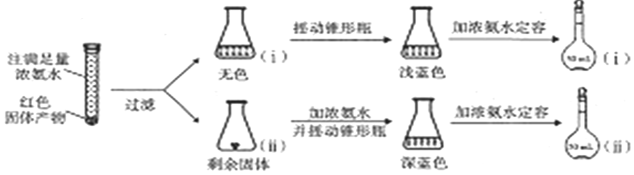
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醇不完全燃烧生成CO和液态水的热化学方程式:CH3OH(l)+O2 (g)═CO(g)+2H2O(l)△H1=-1009.5kJ•mol-1 | |
| B. | CH3OH(l)+$\frac{1}{2}$O2 (g)═CO2(g)+2H2 (g)△H1=-440.7kJ•mol-1 | |
| C. | 2H2O(g)═2H2(g)+O2(g)△H1=+571.6 kJ•mol-1 | |
| D. | 已知:S(s)+O2(g)═SO2(g)△H1;S(g)+O2(g)=SO2(g)△H2;则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由“C(s,石墨)-→C(s,金刚石)△H=+119 kJ•mol-1”可知金刚石比石墨稳定 | |
| B. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ•mol-1 | |
| C. | 在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 | |
| D. | 等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
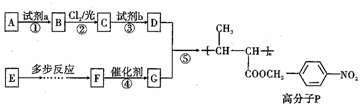
 ,试剂a是浓硫酸和浓硝酸.
,试剂a是浓硫酸和浓硝酸.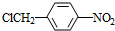 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$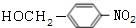 +NaCl.
+NaCl.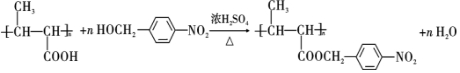 .
.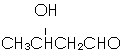 ,以E为起始原料.选用必要的无机试剂合成F,写出合成路线
,以E为起始原料.选用必要的无机试剂合成F,写出合成路线 (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)的燃烧热为571.6 kJ•mol-1 | |
| B. | 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)燃烧放出的热量多 | |
| C. | H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| D. | 3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+135.9 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
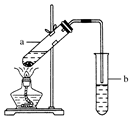 实验室常用如图所示装置制取少量乙酸乙酯.请回答下列问题:
实验室常用如图所示装置制取少量乙酸乙酯.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) | |
| B. | 常温下,在pH=11的溶液中,水电离出的c(OH-)一定等于10-3mol/L | |
| C. | 若强酸、强碱中和后溶液的pH=7,则中和之前酸、碱的pH之和一定等于14 | |
| D. | 将物质的量浓度和体积都相同的一元酸HA与一元碱BOH混合后,溶液呈中性,则反应后溶液中c(H+)=$\sqrt{Kw}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
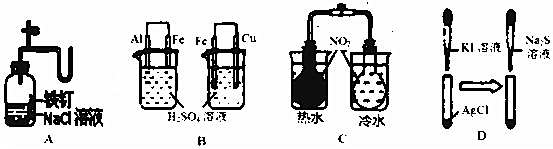
| 实验 | 实验现象 | 结论 |
| A | 广口瓶中光亮的铁钉放置一段时间后生锈 | 铁钉发生析氢腐蚀 |
| B | 左烧杯铁表面冒气泡,右烧杯铜表面冒气泡 | 金属活动性:Al>Fe>Cu |
| C | 左烧杯气体颜色加深,右烧杯气体颜色变浅 | 2NO2(g)?N2O4(g)△H>0 |
| D | 白色固体先变为黄色,后变为黑色 | Ksp:AgCl<AgI<Ag2S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com