
某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g) 4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5∶4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5∶4(相同的温度下测量),则下列说法正确的是( )
A.该反应的化学平衡常数表达式是
B.此时,B的平衡转化率是35%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加C,B的平衡转化率不变
科目:高中化学 来源: 题型:
已知H—H键能为436kJ·mol-1,N—H键能为391kJ·mol-1,根据化学方程式:N2+3H2 2NH3,1mol N2与足量H2反应放出的热量为92.4kJ·mol-1,那么N≡N键的键能是( )
2NH3,1mol N2与足量H2反应放出的热量为92.4kJ·mol-1,那么N≡N键的键能是( )
A.431kJ·mol-1 B.945.6kJ·mol-1 C.649kJ·mol-1 D.896kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
为了说明盐类水解是吸热反应,现用醋酸钠进行实验,表明它在水解时是吸热反应,其中的实验方案正确的是( )
A将CH3COONa·3H2O晶体溶于水,温度降低 B醋酸钠溶液的pH大于7
C醋酸钠溶液滴入酚酞显红色,加热后颜色变深 D醋酸钠溶液与浓H2SO4微热,可逸出醋酸蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用下列方法测定某水样中O2的含量。
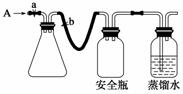
(1)实验原理
用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为____________________。
再用I-将生成的MnO(OH)2还原为Mn2+,反应的离子方程式为MnO(OH)2+2I-+4H+===Mn2++I2+3H2O。然后用Na2S2O3标准溶液滴定生成的I2,反应的化学方程式为I2+2Na2S2O3===2NaI+Na2S4O6。
(2)实验步骤
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是________;
②用注射器抽取某水样20.00 mL从A处注入锥形瓶;
③再分别从A处注入含m mol NaOH溶液及过量的MnSO4溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A处注入足量NaI溶液及含n mol H2SO4的硫酸溶液;
⑥重复④的操作;
⑦取下锥形瓶,向其中加入2~3滴________作指示剂;
⑧用0.005 mol·L-1 Na2S2O3滴定至终点。
(3)数据分析
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为________(单位:mg·L-1)。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将________(填“偏大”、“偏小”或“不变”)。
③实验要求加入适量的H2SO4使溶液接近中性,其原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组对加碘食盐中碘酸钾进行研究。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取W g加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI溶液;
c.以淀粉为指示剂,用物质的量浓度为1.00×10-3 mol·L-1的Na2S2O3标准溶液滴定。
(已知:IO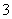 +5I-+6H+===3I2+3H2O,I2+2S2O
+5I-+6H+===3I2+3H2O,I2+2S2O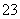 ===2I-+S4O
===2I-+S4O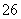 )
)
滴定时Na2S2O3溶液应放在________(填“酸式滴定管”或“碱式滴定管”),滴定至终点时消耗Na2S2O3溶液20.00 mL,其终点颜色变化为________;加碘食盐样品中的碘元素含量是____________mg·kg-1(以含W的代数式表示)。
(2)学生乙对纯净的NaCl(不含KIO3)进行了下列实验:
| 顺序 | 步骤 | 实验现象 |
| ① | 取少量纯净的NaCl, 加蒸馏水溶解 | 溶液无变化 |
| ② | 滴加淀粉KI溶液,振荡 | 溶液无变化 |
| ③ | 然后再滴加稀H2SO4溶液,振荡 | 溶液变蓝色 |
请推测实验③中产生蓝色现象的可能原因:__________;根据学生乙的实验结果,请对学生甲的实验结果作出简要评价____________________。
(3)工业上通常用电解KI溶液的方法来制备碘酸钾,电解过程中请你帮助学生丙设计实验来判断电解是否完全。仪器不限,可选的试剂:淀粉溶液、H2O2溶液、稀硫酸。
| 实验操作 | 实验现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有四种短周期元素,它们的结构、性质等信息如下表所述:
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 可用作制冷剂,元素的气态氢化物极易溶于水 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)A原子的核外电子排布式 。
(2)B元素在周期表中的位置 ;离子半径:B A(填“大于”或“小于”)。
(3)C原子的电子排布图是 ,其原子核外有 个未成对电子,能量最高的电子为 轨道上的电子,其轨道呈 形。
(4)D原子的电子排布式为 ,D-的结构示意图是 。
(5)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为 。与D的氢化物的水化物反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将4 mol A气体和2 mol B气体在2 L的容器中混合,并在一定条件下发生如下反应2A(g)+B(g)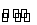 2C
2C (g),若2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法,其中正确的是( )
(g),若2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法,其中正确的是( )
①用物质A表示反应的平均速率为0.3 mol·L-1·s-1
②用物质B表示反应的平均速率为0.6 mol·L-1·s-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol·L-1
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关钢铁腐蚀说法正确的是( )
A.钢铁腐蚀时铁作正极
B.钢铁腐蚀时铁发生的反应为:Fe-3e-====Fe3+
C.在碱性环境中正极反应式为:O2+2H2O+4e-====4OH-
D.在酸性环境中正极反应式为:O2+4H++4e-====2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数的值,下列有关叙述正确的是( )
A.1 mol CH4(g)和2 mol O2(g)的能量总和小于1 mol CO2(g)和2 mol H2O(g)的能量总和
B.标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数小于2NA
C.1 mol Fe在氧气中充分燃烧失去3NA个电子
D.在标准状况下,NA个CHCl3分子所占的体积约为 22.4 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com