
| | ¢Ł | ¢Ś | ¢Ū | ¢Ü | ¢Ż |
| ČÜŅŗ | °±Ė® | ĒāŃõ»ÆÄĘ | “×Ėį | ŃĪĖį | “×ĖįÄĘ |
| pH | 11 | 11 | 3 | 3 | 8£®3 |



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®c(H£«) | B£®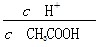 |
| C£®c(H£«)”¤c(OH£) | D£®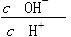 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| ČõĖį»ÆѧŹ½ | CH3COOH | HCN | H2CO3 |
| µēĄėĘ½ŗā ³£Źż(25 ”ę) | 1.8”Įl0£5 | 4.9”Įl0£10 | K1£½4.3”Įl0£7 K2£½5.6”Įl0£11 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| ČõĖį | HCOOH | HCN | H2CO3 |
| µēĄėĘ½ŗā ³£Źż(25”ę) | Ki£½1.77”Į10£4 | Ki£½4.9”Į10£10 | Ki1£½4.3”Į10£7 Ki2£½5.6”Į10£11 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ÉżøßĪĀ¶Č,ČÜŅŗµÄpH»įŌö“ó |
| B£®¼ÓČėÉŁĮæ¹ĢĢåNaOH,ČÜŅŗÖŠc(CH3COO-)+c(OH-)>c(Na+)+c(H+) |
| C£®¼ÓČėÉŁĮæ0.2 mol”¤L-1µÄĮņĖįČÜŅŗ,Ė®µēĄė²śÉśµÄc(H+)¼õŠ” |
| D£®Óė0.1 mol”¤L-1µÄNaOHČÜŅŗµČĢå»ż»ģŗĻŗó,ČÜŅŗÖŠc(CH3COO-)=c(Na+) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®øĆČÜŅŗÖŠ“ęŌŚ£ŗ c(Na+) + c(H+)=c(OH”Ŗ)+c(CH3COO”Ŗ) |
| B£®¼ÓČė·ÓĢŖŗó¼ÓČČ£¬ČÜŅŗŃÕÉ«±äĒ³ |
| C£®ČōŌŚøĆČÜŅŗŌŁĶØČė0.1mol HCl£¬“ęŌŚ£ŗ c(Na+)£¾c(CH3COO”Ŗ)£¾ c(H+) |
| D£®ČōŌŚøĆČÜŅŗÖŠŌŁĶ¶Čė0.1mol NaCl£¬“ęŌŚ£ŗ c(Na+)=c(Cl”Ŗ)+c(CH3COO”Ŗ)+c(CH3COOH) |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com