
| A、78 g Na2O2与足量水反应中电子转移了0.2NA |
| B、1 mol甲基中含有7 NA 个电子 |
| C、62 g白磷中含P-P键为3 NA |
| D、1 mol氖气含有的原子数为2 NA |
 ,1mol甲基中含有9mol电子,含有9NA 个电子,故B错误;
,1mol甲基中含有9mol电子,含有9NA 个电子,故B错误;

科目:高中化学 来源: 题型:
+ 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Na2CO3溶液中滴入酚酞试液,溶液变红CO32-+2H2O?H2CO3+2OH- |
| B、向AgC1悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgC1+S2-=Ag2S↓+2C1- |
| C、铜器在潮湿的环境中表面生成一层“铜绿”:Cu+O2+CO2=CuCO3 |
| D、向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
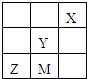 四种非金属主族元素M、X、Y、Z在周期表中相对位置如图,下列判断不正确的是( )
四种非金属主族元素M、X、Y、Z在周期表中相对位置如图,下列判断不正确的是( )| A、Z的氢化物中中心原子的杂化方式为sp3 |
| B、Z原子的第一电离能小于M原子的第一电离能 |
| C、四种元素全部位于p区 |
| D、M、Y、Z最高价氧化物对应水化物的酸性从强到弱的顺序为:Y>M>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、夏天冰镇啤酒倒入杯中,泛起大量泡沫 |
| B、氯水保存要在低温暗处 |
| C、工业上制氨要用高温,催化剂 |
| D、为提高SO2转化成SO3的量,常通入过量氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①⑤ |
| C、②③④ | D、②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
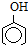 )>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(
)>K2(H 2CO3),且知苯甲酸酸性比碳酸强,水杨酸(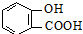 )与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )
)与碳酸钠溶液反应生成CO2的同时,不能生成的物质是( )A、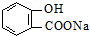 |
| B、NaHCO3 |
C、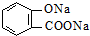 |
| D、H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com