
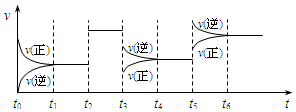
 某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是| A. | t2时加入了催化剂 | B. | t3时降低了温度 | ||
| C. | t5时升高了温度 | D. | t4~t5时间内转化率一定最低 |
分析 t2时刻,改变条件时,正逆反应速率都增大且仍然相等,说明平衡不移动,该反应前后气体计量数之和改变,所以改变的条件只能是催化剂;
t3时刻,改变条件时,正逆反应速率都减小,且逆反应速率大于正反应速率,平衡逆向元素,该反应的正反应是放热反应,则改变的条件应该是压强;
t5时刻,改变条件时,正逆反应速率都增大,正反应速率大于逆反应速率,平衡正向移动,改变的条件应该是温度,以此解答该题.
解答 解:A.由上述分析可知,t2时刻,使用催化剂,故A正确;
B.该反应放热,如降低温度,则平衡正向移动,正反应速率大于逆反应速率,故B错误;
C.由上述分析可知,t5时刻,改变条件是升高温度,故C正确;
D.t2时刻平衡不移动,t3、t5时刻平衡逆向移动,所以t6时刻后参加反应的反应物物质的量最少,则反应物的转化率最低,故D错误.
故选AC.
点评 本题考查图象分析,为高频考点,题目难度中等,侧重考查学生分析判断能力,明确外界条件对反应速率影响、平衡移动影响即可解答,难点是平衡移动原理的灵活运用.


科目:高中化学 来源: 题型:选择题
| A. | 增大压强或降低温度,平衡常数K都增大 | |
| B. | 其它条件相同,向容器中只加入2molZ,能建立完全相同的平衡状态 | |
| C. | 平衡时,平衡常数K=36a(mol/L)-1 | |
| D. | 某时刻X、Y、Z物质的量分别是0.3mol,1mol和1.1mol,反应正向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水中只含Cl2和H2O分子 | |
| B. | 新制氯水不能使干燥的有色布条褪色 | |
| C. | 光照氯水有气泡逸出,该气体是Cl2 | |
| D. | 新制氯水可使蓝色石蕊试纸先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCCl4含有NA个分子 | |
| B. | 0.1mol/L的HNO3中有0.1NA个H+ | |
| C. | 常温常压下,8gO2含有4NA个电子 | |
| D. | 1molNa被完全氧化生成Na+,失去2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石与醋酸反应制取二氧化碳:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 氯乙酸与足量氢氧化钠溶液共热:CH2ClCOOH+OH-→CH2ClCOO-+H2O | |
| C. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| D. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与电源正极相连的是电解槽的阴极 | |
| B. | 与电源负极相连的电极发生还原反应 | |
| C. | 在电解槽的阳极发生氧化反应 | |
| D. | 电子从电源的负极沿导线流入阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
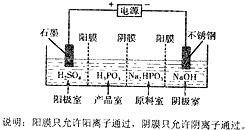
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com