
| A. | 对于任何化学反应来说,反应速率越大,反应现象越明显 | |
| B. | 化学反应速率为“0.8mol/(L•min)”表示的意思是:时间为1s时,某物质的浓度为0.8mol/L | |
| C. | 化学反应达到平衡状态,反应停止 | |
| D. | 化学反应速率是定量描述化学反应快慢的物理量 |
分析 化学反应速率为单位时间内浓度的变化,是定量描述化学反应快慢的物理量,反应速率的快慢不一定与现象有关,以此解答该题.
解答 解:A.反应速率快的现象不一定明显,如NaOH与HCl的反应,反应速率慢的现象可能明显,如铁生锈,故A错误;
B.化学反应速率为“0.8mol/(L•s)”表示的意思是:一段时间内,某物质的平均速率为0.8mol/(L•s),故B错误;
C.化学反应为动态平衡,达到平衡时,反应没有停止,故C错误;
D.化学反应速率为单位时间内浓度的变化,是定量描述化学反应快慢的物理量,故D正确.
故选D.
点评 本题考查化学反应速率的概念及影响因素、为高频考点,侧重于学生的分析能力的考查,注意反应速率与反应现象的关系,难度不大.要注意化学反应速率是平均速率,不是瞬时速率.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 编号 | ① | ② | ③ | ④ |
| 装置 | 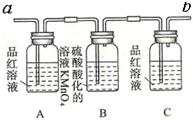 | 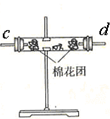 | 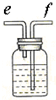 | 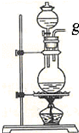 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
| A. | 反应在前50s的平均反应速率为v(PCl3)=0.0064 mol/(L•s) | |
| B. | 若保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol/L,则反应的△H<0 | |
| C. | 相同温度下,起始时向该容器中充入4.0 mol PCl3、4.0 mol Cl2,达到平衡时,PCl3的转化率小于80% | |
| D. | 相同温度下,起始时向该容器中充入2.0 mol PCl5、0.40 mol PCl3和0.40 mol Cl2,达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
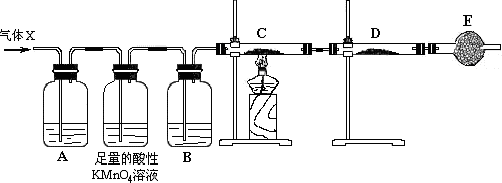
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物的浓度,平衡常数K增大 | B. | 加大体系压强,平衡常数K增大 | ||
| C. | 加入负催化剂,平衡常数K减小 | D. | 升高温度,平衡常数K发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减小压强 | B. | 降低温度 | C. | 更换催化剂 | D. | 减小CO的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
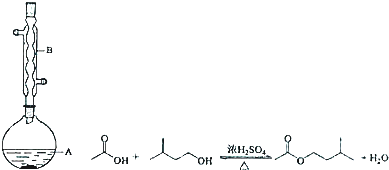
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戍醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验方案与步骤 | 实验现象和结论 |
| 1.将少量气体通入盛有少量品红溶液的试管内; | 若品红溶液褪色,则无色气体中有SO2. |
| 2.将气体通过装有足量氢氧化钠溶液的洗气瓶后,用小试管收集气体,并在酒精灯上点燃 | 若收集到气体可以燃烧,则无色气体中有H2. 结合以上实验可知假设三成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 391 | B. | 194 | C. | 516 | D. | 658 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com