


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源:不详 题型:单选题
| A.用酒精萃取碘水中的碘 |
| B.用蒸馏的方法将自来水制成蒸馏水 |
| C.用溶解、过滤的方法分离硝酸钾和沙子 |
| D.用加热的方法分离氯化钠和氯化铵固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 编号 | 实验 | 结论 |
| A | 向某溶液中加入稀盐酸,将产生的气体通入澄清石灰水,石灰水变浑浊 | 该溶液一定是碳酸盐溶液 |
| B | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色 | 该溶液不一定是钠盐溶液 |
| C | 往淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液并水浴加热,无银镜出现 | 该淀粉未发生水解 |
| D | 向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色 | 该溶液中一定含Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
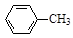 + 2KMnO4
+ 2KMnO4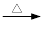
 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O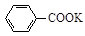 + HCl
+ HCl
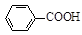 +KCl
+KCl
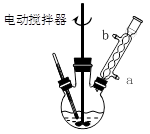
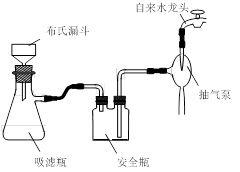
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.澄清石灰水,浓H2SO4 | B.酸性KMnO4,浓H2SO4 |
| C.溴水,浓H2SO4 | D.浓H2SO4,溴水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

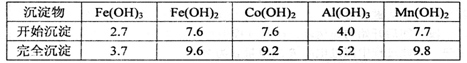

| A.2.0~2.5 | B.3.0~3.5 | C.4.0~4.5 | D.5.0~5.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com