D
分析:①四氯化碳标准状况不是气体;
②依据n=
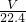
=
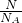
计算得到;
③电解精炼阳极是粗铜含有铁、锌、镍等金属失电子,阴极得到电子生成铜,阳极溶解的不全是铜;
④依据n=

计算物质的量结合分子式计算原子数;
⑤氯气和氢氧化钠溶液反应是自身氧化还原反应,氯元素化合价从0价变化为-1价和+1价;
⑥依据n=
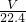
计算物质的量,结合一氧化氮和氧气反应生成二氧化氮,二氧化氮聚合为四氧化二氮分析;
⑦盐酸中无氯化氢分子.
解答:①标准状况四氯化碳为液体,2.24L四氯化碳物质的量不是0.1mol,故①错误
②标准状况下,a L的氧气和氮气的混合气体物质的量=
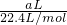
,含有分子的数目为
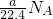
,故②正确;
③阴极析出铜,但阳极溶解的是铜、铁、锌等,质量减小不是64g,故③错误;
④7gC
nH
2n分子中含有氢原子数=
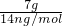
×2n×N
A=N
A,故④错误;
⑤氯气和氢氧化钠溶液反应是自身氧化还原反应,氯元素化合价从0价变化为-1价和+1价,7.1g氯气物质的量为0.1mol,与足量的氢氧化钠溶液反应转移的电子数为0.1N
A,故⑤正确;
⑥标况下22.4L NO物质的量为1mol,11.2L O
2物质的量为0.5mol,混合后恰好反应生成二氧化氮1mol,由于存在2NO
2=N
2O
4,所得气体分子的数目小于N
A,故⑥错误;
⑦盐酸溶液中无氯化氢分子,故⑦错误;
故选D.
点评:本题考查了阿伏伽德罗常数的应用,主要是气体摩尔体积的条件应用,电极精炼的原理分析,氧化还原反应电子转移计算,题目难度中等.

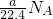
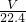 =
=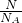 计算得到;
计算得到; 计算物质的量结合分子式计算原子数;
计算物质的量结合分子式计算原子数;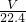 计算物质的量,结合一氧化氮和氧气反应生成二氧化氮,二氧化氮聚合为四氧化二氮分析;
计算物质的量,结合一氧化氮和氧气反应生成二氧化氮,二氧化氮聚合为四氧化二氮分析;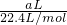 ,含有分子的数目为
,含有分子的数目为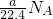 ,故②正确;
,故②正确;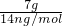 ×2n×NA=NA,故④错误;
×2n×NA=NA,故④错误;

 阅读快车系列答案
阅读快车系列答案