
 H2SO3; H2SO3
H2SO3; H2SO3  H++HSO3-;HSO3-
H++HSO3-;HSO3-  H++SO32-.
H++SO32-.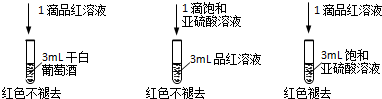
分析 Ⅰ.(1)存在二氧化硫气体的溶解平衡,亚硫酸的电离平衡,亚硫酸氢根的电离平衡;
(2)1滴饱和亚硫酸溶液滴入3mL品红溶液中不褪色,而1滴品红溶液滴入3mL饱和亚硫酸溶液中褪色,说明二氧化硫或亚硫酸的含量会影响漂白效果;
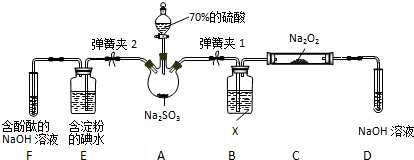
Ⅱ.A中制备二氧化硫,X干燥二氧化硫,C中检验SO2与Na2O2反应是否有氧气,D中氢氧化钠溶液吸收剩余的二氧化硫,防止污染空气.E装置验证二氧化硫的还原性,F装置验证二氧化硫为酸性气体,并吸收二氧化硫,防止污染空气;
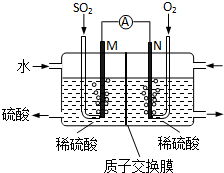
Ⅲ.(1)本质是二氧化硫、氧气与水反应生成硫酸,M电极为负极,N电极为正极,M电极上二氧化硫失去电子氧化生成SO42-,根据原子守恒会电荷守恒可知,有水参加反应,有氢离子生成;
(2)根据电流计算电量,再计算转移电子物质的量,根据电子转移守恒计算通入二氧化硫物质的量,进而计算体积.
解答 解:Ⅰ.(1)存在二氧化硫气体的溶解平衡,亚硫酸的电离平衡,亚硫酸氢根的电离平衡,平衡方程式有:SO2+H2O  H2SO3; H2SO3
H2SO3; H2SO3  H++HSO3-;HSO3-
H++HSO3-;HSO3-  H++SO32-,
H++SO32-,
故答案为:SO2+H2O  H2SO3; H2SO3
H2SO3; H2SO3  H++HSO3-;HSO3-
H++HSO3-;HSO3-  H++SO32-;
H++SO32-;
(2)1滴饱和亚硫酸溶液滴入3mL品红溶液中不褪色,而1滴品红溶液滴入3mL饱和亚硫酸溶液中褪色,说明二氧化硫或亚硫酸的含量会影响漂白效果,干白葡萄酒不能使品红溶液褪色,原因为:干白中二氧化硫或亚硫酸含量太少,
故答案为:干白中二氧化硫或亚硫酸含量太少;
Ⅱ.A中制备二氧化硫,X干燥二氧化硫,C中检验SO2与Na2O2反应是否有氧气,D中氢氧化钠溶液吸收剩余的二氧化硫,防止污染空气.E装置验证二氧化硫的还原性,F装置验证二氧化硫为酸性气体,并吸收二氧化硫,防止污染空气.
(1)装置B中试剂X干燥氯气,盛放试剂是浓硫酸,装置D中盛放NaOH溶液的作用是:吸收未反应的SO2,防止污染空气,
故答案为:浓硫酸;吸收未反应的SO2,防止污染空气;
(2)检验SO2与Na2O2反应是否有氧气生成的方法是:将带火星的木条放在D试管口处,看木条是否复燃,
故答案为:将带火星的木条放在D试管口处,看木条是否复燃;
(3)能说明I-还原性弱于SO2的现象为:E中溶液蓝色褪去,发生反应的离子方程式是:SO2+I2+2H2O=2I-+SO42-+4H+,
故答案为:E中溶液蓝色褪去; SO2+I2+2H2O=2I-+SO42-+4H+;
Ⅲ.(1)本质是二氧化硫、氧气与水反应生成硫酸,M电极为负极,N电极为正极,M电极上二氧化硫失去电子氧化生成SO42-,根据原子守恒会电荷守恒可知,有水参加反应,有氢离子生成,电极反应式为:SO2+2H2O-2e -═SO42-+4H+,
故答案为:SO2+2H2O-2e -═SO42-+4H+;
(2)转移电子物质的量为(2A×60s÷1.6×10-19C)÷6.02×1023mol-1,则需要氧气体积为:[(2A×60s÷1.6×10-19C)÷6.02×1023mol-1]÷2×22.4L/mol≈0.014L,
故答案为:0.014.
点评 本题考查物质性质探究实验、原电池原理及计算等,掌握物质的性质理解原理是解题的关键,是对知识的综合考查,需要学生具有扎实的基础与分析问题、解决问题的能力.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:解答题


 .
. .
. 等.(任写一种)
等.(任写一种)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 通入少量SO2,溶液漂白性增强 | |
| B. | 加入少量NaHCO3固体,c(ClO)减小 | |
| C. | 加入少量水,水的电离平衡向正方向移动 | |
| D. | 加入NaOH固体至恰好完全反应,一定有c(Na+)=c(Cl-)+c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| B. | 硅胶可用作食品干燥剂 | |
| C. | “天宫一号”使用的碳纤维,是一种新型有机高分子材料 | |
| D. | 工业上燃烧煤时,加入少量石灰石是为了减少CO2的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 装置 | 原理 |
| A | 分离乙酸乙酯和乙醇 |  | 乙酸乙酯和乙醇的密度不同 |
| B | 实验室制备氨气 |  | 2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O |
| C | 证明非金属性N>C>Si |  | 最高价含氧酸酸性:硝酸>碳酸>硅酸 |
| D | 除去丁醇中的乙醚 |  | 丁醇和乙醚的沸点不同 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
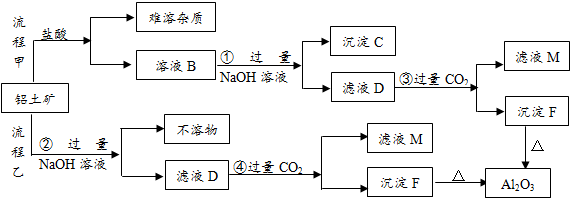
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 氢化物的沸点排序:Y>T>R | |
| C. | 最高价氧化物对应的水化物的酸性:T<R | |
| D. | 单质氧化性:Y>R>T |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com