
分析 (1)1mol硫酸铝含有2mol铝离子,3mol硫酸根离子;m=nM;
(2)摩尔质量是M g/mol,是指1mol该原子质量为Mg,1mol该原子含有NA个原子;
(3)先根据n=$\frac{V}{Vm}$计算出标准状况下aL氯化氢的物质的量,然后根据m=nM计算出氯化氢的质量,1L水的质量约为1000g,从而可知溶液质量,再根据V=$\frac{m}{ρ}$计算出所得溶液体积,最后根据c=$\frac{n}{V}$计算出该盐酸的物质的量浓度;
(4)①标况下混合气体的体积为8.96L,其物质的量为:$\frac{8.96L}{22.4L/mol}$=0.4mol,根据M=$\frac{m}{M}$计算出平均摩尔质量;
②设出一氧化碳、二氧化碳的物质的量,根据气体的总质量和总物质的量列方程式计算.
解答 解:(1)0.1molAl2(SO4)3中含有离子,含有0.2mol铝离子,0.3mol硫酸根离子,共0.5mol离子,个数为0.5NA;Al3+的质量是:0.2mol×27g/mol=5.4g;
故答案为:0.5 NA ;5.4 g; 0.3 mol;
(2)若某原子的摩尔质量是M g/mol,则1mol该原子含有NA个原子,质量为Mg,则一个原子的质量为:$\frac{M}{{N}_{A}}$g;
故答案为:$\frac{M}{{N}_{A}}$;
(3)标准状况下的a L 氯化氢气体的物质的量为:n(HCl)=$\frac{aL}{22.4L/mol}$=$\frac{a}{22.4}$mol,该HCl的质量为:36.5g/mol×$\frac{a}{22.4}$mol=$\frac{36.5a}{22.4}$g,
1L水的质量约为1000g,则该盐酸质量为:1000g+$\frac{36.5a}{22.4}$g,
该盐酸的体积为:$\frac{1000g+\frac{36.5a}{22.4}}{bg/mL}$=$\frac{22400+36.5}{22.4b}$mL,即:$\frac{22400+36.5}{22.4b}$×10-3L;
则:C(HCl)=$\frac{n}{V}$=$\frac{1000ab}{22400+36.5a}$mol/L,所以该盐酸的物质的量浓度为:c(HCl)=$\frac{1000ab}{22400+36.5a}$mol/L,
故答案为:$\frac{1000ab}{22400+36.5a}$mol/L;
(4)①标况下混合气体的体积为8.96L,其物质的量为:$\frac{8.96L}{22.4L/mol}$=0.4mol,混合气体的平均摩尔质量为:$\frac{14.4g}{0.4mol}$=36g/mol,
故答案为:36g/mol;
②设混合气体中CO的物质的量为xmol,CO2的物质的量为ymol,则根据混合物的质量为14.4g可得:28x+44y=14.4 ①;
根据气体的物质的量为0.4mol可得:x+y=0.4 ②
解①②得:x=0.2mol、y=0.2mol.
由于CO和CO2中均含1个碳原子,故0.2molCO和0.2molCO2中共含0.4molC原子即0.4NA个,
故答案为:0.4NA;
点评 本题考查了有关混合物反应的计算,题目难度中等,为高频考点,试题侧重于学生的分析能力和计算能力的考查,注意质量守恒定律在化学计算中的应用方法.


科目:高中化学 来源: 题型:选择题
| A. | 盛浓盐酸的分液漏斗可用长颈漏斗代替 | |
| B. | 可在集气瓶口放一张湿润的淀粉碘化钾试纸,观察氯气是否收集满 | |
| C. | 用饱和食盐水吸收尾气 | |
| D. | 为了便于学生观察氯气的制备实验,可在讲台上直接做氯气的制备实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
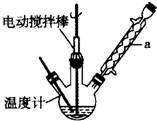 甲苯(
甲苯(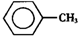 )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(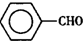 )、苯甲酸(
)、苯甲酸(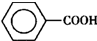 )等产品.下表列出了有关物质的部分物理性质,请回答:
)等产品.下表列出了有关物质的部分物理性质,请回答:| 称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度(ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
 ,此反应的原子利用率理论上可达66.25%.
,此反应的原子利用率理论上可达66.25%.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com