


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源:不详 题型:填空题
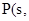 白磷
白磷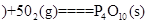 △H=-2983.2KJ/mol
△H=-2983.2KJ/mol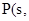 红磷
红磷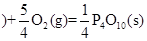 △H=-738.5KJ/mol
△H=-738.5KJ/mol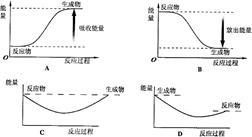
查看答案和解析>>
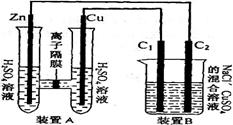
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
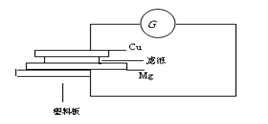
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.Mg比Al活泼,Mg 失去电子被氧化成Mg2+ |
| B.负极反应式为:Al+4OH--3e-=AlO2-+2H2O |
| C.该电池的内外电路中,电流均是由电子定向移动形成的 |
| D.Al是电池阴极,开始工作时溶液中会立即有白色沉淀析出 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
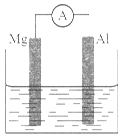
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Zn ∣H2SO4(稀)∣Fe | B.Cu ∣ AgNO3(aq)∣ Ag |
| C.Zn ∣ CCl4∣ Cu | D.Fe ∣ H2SO4(稀) ∣ Fe |
查看答案和解析>>
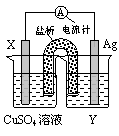
科目:高中化学 来源:不详 题型:单选题
| 选项 | 电极反应式 | 出现的环境 |
| A | O2 + 2H2O + 4e- =" " 4OH- | 碱性环境下氢氧燃料电池的负极反应 |
| B | 4OH- - 4e- = O2↑+ 2H2O | 弱酸性环境下钢铁的吸氧腐蚀 |
| C | 2H+ + 2e- =H2↑ | 用铜做电极电解NaOH溶液的阴极反应 |
| D | H2 – 2e- = 2H+ | 用惰性电极电解H2SO4溶液的阳极反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.负极反应为:O2+ 2H2O + 4e-= 4OH- |
| B.负极反应为:CH4+ 10OH-- 8e- = CO32-+ 7H2O |
| C.放电时溶液中的阴离子向负极移动 |
| D.随着放电的进行,溶液的pH值不发生改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com