
| A. | 254gI2(g)中通入2gH2(g),反应放热9.48kJ | |
| B. | 当反应②吸收52.96kJ热量时转移2mole- | |
| C. | 反应②的反应物总能量比反应①的反应物总能量低 | |
| D. | 1mol固态碘与1mol气态碘多了17.00kJ能量 |
分析 热化学方程式的理解问题,并且注意热化学方程式的表达与现行教材中表达不一样,①是放热反应,②是吸热反应,这个与热化学方程式的△H不同.了解此点,解答很容易.热化学方程式的书写一般是结合计算进行考查,所以应分两步:(1)写,特别注意注明各物质的状态,计量数可以是分数;(2)算,根据题意计算反应热;并注意盖斯定律在计算反应热中的应用来解答.
解答 解:A.因为是可逆反应,所以不能进行完全,放热小于9.48kJ,故A错;
B、当反应②吸收52.96kJ热量时,反应了2mol氢气电子转移4mole-,故B错误;
C、气体I2比固体I2能量高,反应②的反应物总能量比反应①的反应物总能量低,故C正确;
D、根据盖斯定律,用题干中热化学方程式②-①得到I2(S)?I2(g)△H=35.96KJ/L,故D错误;
故选C.
点评 本题考查了热化学方程式的知识应用,主要考查可逆反应不能进行彻底,焓变是完全反应是的能量变化,盖斯定律的应用,题目难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀氨水中滴加稀盐酸至恰好中和:[NH4+]═[Cl-] | |
| B. | 硫酸钠溶液中:[Na+]+[H+]═[OH-]+2[SO42-] | |
| C. | 0.1mol?L-1Na2S溶液中:[S2-]+[HS-]+[H2S]═[Na+] | |
| D. | 向CH3COONa溶液中加适量蒸馏水:[CH3COO-]与[OH-]都减小,[OH-]/[CH3COO-]也减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的电离常数先增大后减小 | |
| B. | 当氨水和甲酸溶液体积相等时,c(HCOO-)=c(NH4+) | |
| C. | c(NH3•H2O)与c(NH4+)之和始终保持不变 | |
| D. | $\frac{c(N{{H}_{4}}^{+})c(HCO{O}^{-})}{c(N{H}_{3}•{H}_{2}O)c(HCOOH)}$始终保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;Z2X4结构式
;Z2X4结构式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
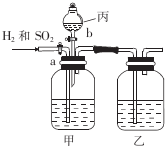 为了分离H2和SO2,并分别得到干燥的气体,某学生设计了一个实验装置.(a、b为活塞,且每个装置中的溶液均过量)
为了分离H2和SO2,并分别得到干燥的气体,某学生设计了一个实验装置.(a、b为活塞,且每个装置中的溶液均过量)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,不能使混合物中的水分完全蒸干后才停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com