
| A. | 各物质的浓度之比为1:3:3 | |
| B. | 混合物各物质的浓度相等 | |
| C. | ν(A)、ν(B)、ν(C) 之比为1:3:3 | |
| D. | A、B、C三种物质的浓度不随时间变化而变化 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
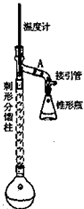 乙酰苯胺,白色由光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂,退热剂.防腐剂和染料中间体,制备原理如下:
乙酰苯胺,白色由光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂,退热剂.防腐剂和染料中间体,制备原理如下:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用3体积的乙醇与l体积的浓H2SO4混合加热到170℃制乙烯 | |
| B. | 加入适量浓溴水除去苯中混有的少量苯酚 | |
| C. | 用饱和食盐水和电石(CaC2)在启普发生器中制乙炔 | |
| D. | 以硫酸、碳酸钠、苯酚钠溶液为试剂,验证酸性强弱关系:硫酸>碳酸>石炭酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
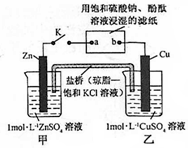
| A. | 片刻后甲池中c(SO42-)增大 | B. | 电子沿 Zn→a→b→Cu 路径流动 | ||
| C. | Cu 电极上发生还原反应 | D. | 片刻后可观察到滤纸b点变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ”表示)位于该正方体的顶点或面心;阴离子(用“
”表示)位于该正方体的顶点或面心;阴离子(用“ ”表示)位于小正方体的中心.根据以上信息,回答下列问题:A至E的元素名称:
”表示)位于小正方体的中心.根据以上信息,回答下列问题:A至E的元素名称:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛是一种有刺激性气味的气体 | |
| B. | 石油通过裂解可以得到更多的汽油,可以满足工业需求 | |
| C. | 乙醇易溶于水是因为含有羟基 | |
| D. | 氟氯代烷产生的自由基可以作为催化剂使O3转化为O2,从而破坏臭氧层 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com