
| A. | 9% | B. | 18% | C. | 36% | D. | 72% |
分析 淀粉在酸性条件下水解生成葡萄糖,加碱中和之后溶液呈碱性,然后加入银氨溶液有银单质生成,淀粉遇碘单质变蓝,根据关系式(C6H10O5)n~nC6H12O6~2nAg计算.
解答 解:(C6H10O5)n淀粉+nH2O$→_{△}^{稀硫酸}$nC6H12O6(葡萄糖),
(C6H10O5)n~nC6H12O6~2nAg
162n 216ng
x 2.16g
解得x=1.62g,
则淀粉的水解率为$\frac{1.62g}{9g}$×100%=18%,
故选B.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,注意-CHO~2Ag,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 3p能级有一个空轨道的基态原子和核外电子的排布为1s22s22p63s23p2的原子 | |
| B. | 2p能级有一个未成对电子的基态原子和价电子排布为 2s22p5的原子 | |
| C. | M层全充满而N层为4s2的原子和核外电子排布为 1s22s22p63s23p63d64s2的原子 | |
| D. | 最外层电子数是核外电子总数的1/5的原子和价电子排布为4s24p5的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,化合物A在体内脱氢酶的作用下会氧化为有害物质GHB.如图是关于化合物A的一种制备方法及由A引发的一系列化学反应.
,化合物A在体内脱氢酶的作用下会氧化为有害物质GHB.如图是关于化合物A的一种制备方法及由A引发的一系列化学反应.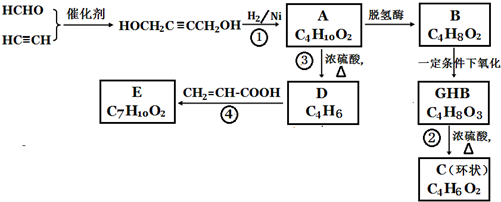
 +H2O.
+H2O.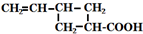 外,还有(写出结构简式)
外,还有(写出结构简式)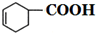 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C、13C和14C | B. | O2和O3 | ||
| C. | CH3CH2CH2CH3和CH3CH (CH3)CH3 | D. | CH3CH2CH3和CH3CH2CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com