
| A.反应过程中MnO2作催化剂 | B.盐酸未完全反应 |
| C.参加反应的盐酸有一半被氧化 | D.反应产生2.24L氯气(标况) |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源:不详 题型:单选题
| A.还原剂是KClO3 | B.HCl被还原 |
| C.得到3molCl2转移6mol电子 | D.氧化产物、还原产物都是Cl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ②NH4Cl的电子式:
②NH4Cl的电子式: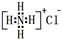
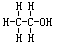 ④Na的结构示意图:
④Na的结构示意图: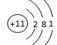 ⑤乙酸的分子式: CH3COOH
⑤乙酸的分子式: CH3COOH 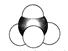 ⑦乙烯的球棍模型:
⑦乙烯的球棍模型: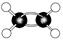
| A.③⑤ | B.②③⑤ | C.③⑤⑥⑦ | D.②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C2H2的电子式为H:C:::C:H |
| B.酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| C.鸡蛋白溶液中滴加饱和硫酸铵溶液,出现沉淀,该过程属于蛋白质的盐析 |
| D.6个碳原子形成的烃分子中,最多有5个碳碳单键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.S2-的结构示意图: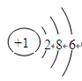 |
| B.原子核内有10个中子,8个质子的原子:18 8O |
| C.HSO3-的电离方程式:HSO3-= H++SO32- |
| D.2gH2在25℃101kPa下燃烧,生成液态的水放出285.8kJ·mol-1的热量,则该反应的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2F2 + 2H2O =" 4HF" + O2 |
| B.Cl2 + H2O =" HCl" + HClO |
| C.BrCl + H2O =" HCl" + HbrO |
| D.2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通过化学变化可以实现35Cl与37Cl间的相互转化 |
| B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| D.电解NaCl溶液得到22.4LH2 (标准状况),理论上需要转移1mol电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.根据某种原子的质量数可以确定该元素的相对原子质量 |
B.H-N=C=O与H-O-C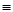 N互为同分异构体 N互为同分异构体 |
| C.化学键存在于化合物中,也可能存在于单质中 |
| D.35Cl与37Cl是两种不同的核素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com