
在容积固定的容器中发生反应:COg)+2H2g)CH3OHg) ΔH<0,各物质的浓度如表所示:
| 浓度 时间 | cCO)/mol·L-1 | cH2)/mol·L-1 | cCH3OH)/mol·L-1 |
| 0 | 0.8 | 1.6 | 0 |
| 2 min | 0.6 | x | 0.2 |
| 4 min | 0.3 | 0.6 | 0.5 |
| 6 min | 0.3 | 0.6 | 0.5 |
下列说法不正确的是 )。
A.2~4 min内用H2表示的平均反应速率为0.3 mol·L-1·min-1
B.达到平衡时,CO的转化率为62.5%
C.反应在第2 min时改变了条件,可能是加入了催化剂
D.反应在第2 min时改变了条件,可能是增加了H2的浓度
解析 直接根据表格计算出2~4 min内vCO)=0.15 mol·L-1·min-1,再换算出vH2)=0.3 mol·L-1·min-1,A正确;达到平衡时CO的转化率为0.5/0.8×100%=62.5%,B正确;由表中数据可知,0~2 min内ΔcCO)=0.2 mol·L-1,则ΔcH2)=0.4 mol·L-1,故x=1.2 mol·L-1,2~4 min内各物质的物质的量浓度改变量大于0~2 min内的改变量,由此可见化学反应速率增大,故改变的条件是加入了催化剂,C正确;2~4 min内,ΔcCO)=0.3 mol·L-1,ΔcH2)也正好为0.6 mol·L-1,故2 min时没有增加H2的浓度,D错误。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
COCl2(g)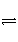
 CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④ B.①④⑥ C.②③⑤ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
分类是学习和研究化学的一种常用的科学方法。下列分类合理的是
①根据酸分子中含有H原子个数将酸分为一元酸、二元酸等
②碱性氧化物一定是金属氧化物
③根据丁达尔现象可将分散系分为胶体、溶液和浊液
④SiO2是酸性氧化物,能与NaOH溶液反应
⑤根据反应的热效应将化学反应分为放热反应和吸热反应
A. ②③ B.②④⑤ C.①②④ D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.等物质的量浓度的硫酸氢铵溶液和氢氧化钠溶液等体积混合:
c(S042-)>c(Na+)>C(NH4+)>c(OH-)=c(H+)
B.常温下0.4mol/LHB溶液和0.2mol/LNaOH溶液等体积混合后溶液的pH=3,则溶液中微粒浓度存在下面关系: c(HB)>c(Na+)>c(B-)>c(H+)>c(OH-)
C.在滴有酚酞溶液的氨水中,加入NH4CI的溶液恰好无色,则此时溶液的PH<7
D.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,若混合液pH=7,则溶液中:2c(R2-)+c(HR-)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是 )。
A.K值不变,平衡可能移动
B.K值变化,平衡一定移动
C.平衡移动,K值可能不变
D.平衡移动,K值一定变化
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在常温常压下:
①2CH3OHl)+3O2g)===2CO2g)+4H2Og)
ΔH1=-1 275.6 kJ·mol-1
②2COg)+O2g)===2CO2g)
ΔH2=-566.0 kJ·mol-1
③H2Og)===H2Ol) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:________________________________________________________
____________________________________________________。
2)H2或CO可以催化还原NO以达到消除污染的目的。
已知:N2g)+O2g)===2NOg)
ΔH=+180.5 kJ·mol-1
2H2g)+O2g)===2H2Ol)
ΔH=-571.6 kJ·mol-1
则H2g)与NOg)反应生成N2g)和H2Ol)的热化学方程式为________________________________________________________
____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
4种短周期主族元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1∶2,X2+和Z-的电子数之差为8。下列说法不正确的是 )。
A.W与Y通过离子键形成离子化合物
B.元素原子半径从大到小的顺序是X>Y>Z
C.WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构
D.W、Y、Z元素的最高价氧化物对应的水化物中酸性最强的元素是Z
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式
A.向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O―→2C6H5OH+CO32-
B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓
C.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2 + 2Fe3+ = 2Fe(OH)3 + 3Mg2+
D.NaHCO3溶液与稀H2SO4反应:CO32-+ 2H+ = H2O + CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.Cl2+2Br-===2Cl-+Br2、Zn+Cu2+===Zn2++Cu均为单质被还原的置换反应(2014·山东理综,7C)
B.2Na2O2+2H2O===4NaOH+O2↑、Cl2+H2O===HCl+HClO均为水作还原剂的氧化还原反应(2014·山东理综,7D)
C.Cl元素的单质在化学反应中只表现氧化性(2013·山东理综,8D)
D.BaSO3与H2O2的反应为氧化还原反应(2013·天津理综,1B)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com