
 按要求完成下列小题.
按要求完成下列小题.分析 (1)依据n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$计算解答,一个氨气分子含有10个电子;
(2)根据质量和体积之间的关系公式m=nM=$\frac{V}{{V}_{m}}$×M来计算;
(3)根据m=nM=cvM计算;
(4)根据n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$结合分子构成计算;
(5)①根据c=$\frac{1000ρω}{M}$计算该盐酸的物质的量浓度;
②盐酸和氢氧化钠反应按1:1反应,据此计算需要浓盐酸的体积.
解答 解:(1)0.5molNH3的质量m=nM=0.5mol×17g/mol=8.5g;0.5molNH3分子含有氨气分子的个数N=nNA=0.5mol×NA=0.5NA,一个氨气分子含有10个电子,因此含有电子数为:10×0.5NA=5NA,
故答案为:8.5g;0.5NA;5NA;
(2)根据质量和体积之间的关系公式m=nM=$\frac{V}{{V}_{m}}$×M可得出,M=$\frac{m{V}_{m}}{V}$=$\frac{0.64g×22.4L/mol}{0.224L}$=64g/mol
故答案为:64g/mol;
(3)实验室配制100mL 0.100mol•L-1 Na2CO3溶液需要Na2CO3•10H2O的质量为:0.1L×0.1mol/L×286g/mol=2.9g,
故答案为:2.9g;
(4)n(CH4)=$\frac{4.8g}{16g/mol}$=0.3mol,
V(CH4)=0.3mol×22.4L/mol=6.72L,
n(H)=0.3mol×4=1.2mol,
则n(H2S)=$\frac{1}{2}$n(H)=0.6mol.
V(H2S)=0.6mol×22.4L/mol=13.44L,
故答案为:6.72;13.44;
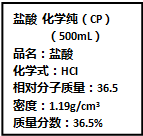
(5)①根据c=$\frac{1000ρω}{M}$可知,该盐酸的物质的量浓度为C=$\frac{1000×1.19×36.5%}{36.5}$mol/L=11.9mol/L
故答案为:11.9mol/L;
②HCl+NaOH=NaCl+H2O,盐酸和氢氧化钠反应按1:1反应,所以需要浓盐酸的体积为$\frac{200mL×1mol/L}{11.9mol/L}$=16.8mL,
故答案为:16.8.
点评 本题综合考查物质的量的计算,侧重于学生计算能力的考查,为高考常见题型,注意把握相关计算公式的运用,难度不大.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:解答题
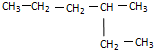 与
与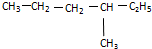 ⑨CS2
⑨CS2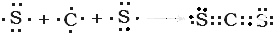 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用滤纸称量氢氧化钠固体 | |
| B. | 将溶解的氢氧化钠溶液转移至容量瓶后,未洗涤烧杯和玻璃棒 | |
| C. | 定容时,俯视刻度线 | |
| D. | 定容后倒转容量瓶几次摇匀溶液,发现凹液面最低点低于刻度线,再补几滴水到刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明的酸性溶液:MnO4-、K+、Cl-、SO42- | |
| B. | 0.1 mol/LNaHCO3溶液:Na+、Ba2+、NO3-、OH- | |
| C. | 使酚酞变红的溶液:K+、Na+、NO3-、Cl- | |
| D. | 滴加KSCN显红色的溶液:NH4+、K+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com