
| A、神舟10号飞船所用太阳能电池板的材料是单晶硅 | B、用于制作集成电路板的酚醛树脂是天然高分子化合物 | C、工业上获得大量乙烯、丙烯、丁二烯的方法是石油裂化 | D、日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 |


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
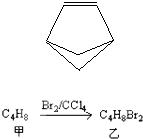 盆烯的分子结构如图所示(其中碳、氢原子均已略去).关于盆烯的说法正确的是( )
盆烯的分子结构如图所示(其中碳、氢原子均已略去).关于盆烯的说法正确的是( )| A、盆烯的一氯取代物有3种 | B、盆烯是乙烯的一种同系物 | C、盆烯是苯的一种同分异构体 | D、盆烯为不饱和烃,能与氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下乙二醇为液态,可用于生产聚酯纤维,其凝固点低,可作发动机抗冻剂 | B、凡含有“-CONH”的化合物均为蛋白质 | C、燃煤烟气用石灰石-石膏法和氨水法脱硫所得的副产品分别为CaSO3和(NH4)2SO4 | D、核磁共振可以检测等效氢的种类比例,仅用核磁共振就可以区分丙酸和丙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 相同条件下NaHCO3的溶解度比Na2CO3的小 | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 |
| B | 钠比铜活泼 | 金属钠可从硫酸铜溶液中置换出铜单质 |
| C | 常温下铝与浓硫酸、浓硝酸均不反应 | 可用铝槽车密封运送浓硫酸、浓硝酸 |
| D | 合成氨反应为吸热反应 | 该反应需在高温条件下进行 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“玉兔号”月球车太阳能电池帆板的材料是二氧化硅 | B、淀粉、纤维素均属于糖类,在人体内可水解为葡萄糖 | C、红外光谱、核磁共振氢谱、原子吸收光谱都可用于有机化合物结构的分析 | D、以苯和乙烯为原料在分子筛固体酸的催化下合成乙苯,该反应符合绿色化学的原则 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三第一次月考理综化学试卷(解析版) 题型:填空题
(16分)在450℃并有催化剂存在下,在体积为1L的密闭恒温容器中,二氧化硫和氧气发生如下反应:2SO2+ O2 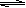 2SO3
2SO3
(1)已知:64g SO2完全转化为SO3会放出85kJ热量。SO2转化为SO3的热化学方程式是 。
(2)该反应的化学平衡常数表达式K= 。
(3)降低温度,化学反应速率 。该反应K值将 。(填“增大”或“减小”或“不变”)
(4)450℃时,在一密闭容器中,将二氧化硫与氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间段是 。
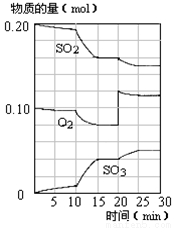
a.10-15min b.15-20min c.20-25min d.25-30min
(5)据图判断,10min到15min的曲线变化的原因可能是 (填写编号)。
a.增加SO3的物质的量 b.增大容器体积 c.降低温度 d.催化剂
(6)在15分钟时,SO2的转化率是 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三第一次月考理综化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1 NaOH溶液:K+、Ba2+、Cl-、HCO3-
B.0.1 mol·L-1 Na2CO3溶液:K+、NH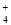 、NO
、NO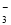 、SO
、SO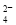
C.0.1 mol·L-1 FeCl3溶液:K+、Na+、I-、SCN-
D. 0.1 mol·L-1 HCl的溶液:Ca2+、Na+、ClO-、NO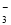
查看答案和解析>>
科目:高中化学 来源:2015届广东省揭阳市高三上学期第一次阶段考试理综试卷(解析版) 题型:填空题
(16分)已知某温度下:
反应①:CO2(g)+H2(g) CO(g)+H2O(g),ΔH= +41.2 kJ/mol;
CO(g)+H2O(g),ΔH= +41.2 kJ/mol;
反应②: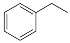 (g)
(g)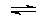
 (g)+H2(g),ΔH= +117.6 kJ/mol。
(g)+H2(g),ΔH= +117.6 kJ/mol。
①、②的化学反应平衡常数分别为K1、K2。
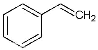
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式 。该反应的化学平衡常数K= (用K1、K2表示)。
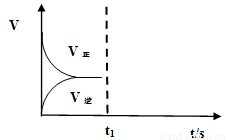
(2)恒温恒容条件下,反应①达到平衡后,t1时刻通入少量CO2。请画出t1之后的正逆反应曲线,并作出标注。
(3)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.50mol/L、c(N2O4)=0.125 mol/L,则2NO2(g) N2O4(g)的平衡常数K= (写出计算结果) ;若NO2起始浓度为2 mol/L,在相同条件下反应达到平衡时,NO2的转化率为 。
N2O4(g)的平衡常数K= (写出计算结果) ;若NO2起始浓度为2 mol/L,在相同条件下反应达到平衡时,NO2的转化率为 。
(4)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应为________反应(填“吸热”、“放热”)。
②能使该反应的反应速率增大,且平衡向正反应方向移动的是 。
A.及时分离出CO气体 B.适当升高温度
C.增大CO2的浓度 D.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三上学期期中考试理综化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W原子序数依次增大,X原子最外层电子数是其电子层数的3倍,Y与X可形成Y2X2和Y2X两种离子化合物,Z原子的核外电子数比Y原子多1,W与X同主族。下列说法正确的是
A.单质的还原性:Y>Z
B.原子半径:Y<Z<W
C.气态氢化物的稳定性:X<W
D.Y和Z的最高价氧化物对应的水化物能相互反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com