
| A、CO2 |
| B、PCl3 |
| C、CCl4 |
| D、BF3 |


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:
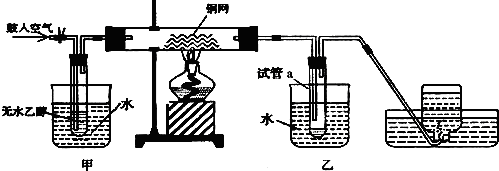
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阳极产生H2 |
| B、阳极产生O2 |
| C、阴产生Li和H2 |
| D、阴极只产生H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
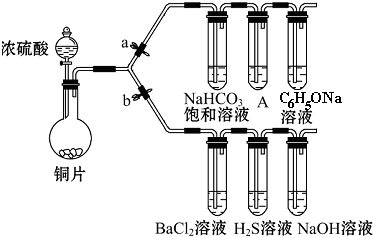
查看答案和解析>>
科目:高中化学 来源: 题型:
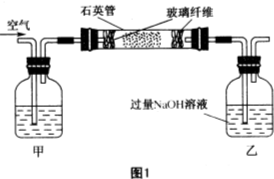 黄铁矿(主要成分为FeS2,含少量其他金属硫化物)曾是我国一些硫酸厂制取硫酸够主要原料.某化学学习小组对黄铁矿石进行如下实验探究:
黄铁矿(主要成分为FeS2,含少量其他金属硫化物)曾是我国一些硫酸厂制取硫酸够主要原料.某化学学习小组对黄铁矿石进行如下实验探究:
| ||
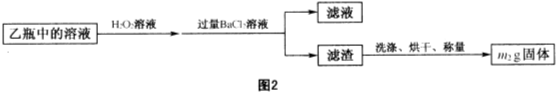
- 4 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 T℃时,容积固定为1L的密闭容器甲中充入2molSO2、1molO2,发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,维持温度为T℃,4min后达到平衡,测得平衡时n(SO3)=1.2mol.
T℃时,容积固定为1L的密闭容器甲中充入2molSO2、1molO2,发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,维持温度为T℃,4min后达到平衡,测得平衡时n(SO3)=1.2mol.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验内容:将木炭与浓硫酸共热,得到的气体通入澄清石灰水.实验目的:检验木炭的氧化产物是CO2. |
| B、实验内容:加入足量铁屑,充分反应后,过滤.实验目的:除去FeCl2溶液中的少量FeCl3. |
| C、实验内容:将1moLCuSO4?5H2O溶解在1L 水中.实验目的:制备1moL/L的CuSO4溶液 |
| D、实验内容:饱和氯化铁溶液中滴加氨水.实验目的:制备Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(B)=0.3 mol?L-1?s-1 |
| B、v(A)=0.5 mol?L-1?s-1 |
| C、v(C)=0.6 mol?L-1?s-1 |
| D、v(D)=1 mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有的油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:
有的油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com