
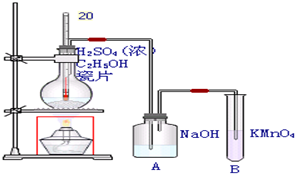
分析 在浓硫酸作用下,加热到170摄氏度时,乙醇发生消去反应生成乙烯,由于浓硫酸具有强氧化性,在生成乙烯的同时可生成少量二氧化硫、二氧化碳,题中A用于除去二氧化硫、二氧化碳,且起到吸收乙醇蒸气的作用,生成乙烯含有碳碳双键,可与酸性高锰酸钾发生氧化还原反应,高锰酸钾溶液褪色,以此解答该题.
解答 解:在浓硫酸作用下,加热到170摄氏度时,乙醇发生消去反应生成乙烯,由于浓硫酸具有强氧化性,在生成乙烯的同时可生成少量二氧化硫、二氧化碳,题中A用于除去二氧化硫、二氧化碳,且起到吸收乙醇蒸气的作用,生成乙烯含有碳碳双键,可与酸性高锰酸钾发生氧化还原反应,高锰酸钾溶液褪色,
(1)沸石(瓷片)起到防止暴沸的作用,故答案为:防止暴沸;
(2)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,浓硫酸起到催化剂、脱水剂的作用,故答案为:催化剂、脱水剂;
(3)由仪器的图形可知B为试管,故答案为:试管;
(4)乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(5)高锰酸钾溶液呈紫色,与乙烯充分发生氧化还原反应后,溶液变为无色,故答案为:溶液变为无色.
点评 本题考查以乙烯的实验室制法以及产物的检验为载体考查物质的性质实验的设计,为高考常见题型,侧重于学生的分析、实验能力的考查,注意当有多种产物需检验时,应考虑先后顺序,高锰酸钾既能氧化二氧化硫,又能氧化乙烯,是解答本题的关键,难度不大.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4++H2O?NH3•H2O+H+ | B. | HCO3-+H2O?H3O++CO32- | ||
| C. | HS-+H+═H2S | D. | Cl2+H2O?H++Cl?+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液(NaHCO3),选用适量的NaOH溶液 | |
| B. | NaHCO3溶液(Na2CO3),应通入过量的CO2气体 | |
| C. | Na2O2粉末(Na2O),将混合物在氧气中加热 | |
| D. | Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠能置换出水中所有的氢,却只能置换出乙醇里羟基中的氢 | |
| B. | 钠都要浮在水面上或乙醇液体表面 | |
| C. | 钠无论与水反应还是与乙醇反应都要放出热量 | |
| D. | 钠在乙醇中反应更剧烈,是因为乙醇分子中含有的氢原子比水分子中的多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X | |
| B. | CaY2与水发生氧化还原反应时,CaY2只作氧化剂 | |
| C. | Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 | |
| D. | CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgF2晶体中的化学键是共价键 | |
| B. | 某化合物在熔融态能导电,则该物质中一定含有离子键 | |
| C. | N2和HCl两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH${\;}_{4}^{+}$ | B. | Mg2+ | C. | Fe2+ | D. | Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
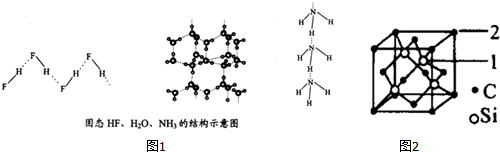
| 物质 | 氢键X-H…Y | 键能KJ•mol-1 |
| (HF)n | F-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com