
 Al(OH)3
Al(OH)3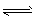 Al3+ +3OH-。 试根据平衡移动原理,解释下列有关问题。
Al3+ +3OH-。 试根据平衡移动原理,解释下列有关问题。科目:高中化学 来源: 题型:
钠、镁、铝是重要的金属元素,与我们的生活和生产关系密切。
(1)元素的性质特别是化学性质取决于元素原子结构。钠离子的电子排布式为_______,铝元素的原子结构示意图为_________。
(2)钠、镁、铝元素的阳离子半径由小到大的顺序是_____________(用离子符号表示)。在短周期中非金属性最强的元素位于第____周期____族。
(3)钠、镁、铝的单质及其化合物在某些性质上存在着递变规律。下列有关说法正确的是___________(选填编号)。
a.三种元素的金属性越强,金属单质的熔点就越高
b.其碱性按NaOH、Mg(OH)2、Al(OH)3顺序依次减弱
c.常温下都能与浓硝酸剧烈反应生成硝酸盐,但剧烈程度依次减弱
d.等质量的钠、镁、铝与足量稀硫酸反应生成氢气的物质的量依次增加![]()
(4)1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定氟元素的电负性为4,并通过热化学方法建立了其他元素的电负性。第三周期主族元素的电负性如下:
| 元素 | Na | Mg | Al | Si | P | S | Cl |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
从上表可以看出电负性的大小与元素非金属性的强弱关系是____________________;大量事实表明,当两种元素的χ值相差大于或等于1.7时,形成的化合物一般是离子化合物,根据此经验规律,AlBr3中的化学键类型应该是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
完成下列各小题中的化学反应方程式。
⑴碱金属与O2反应生成氧化物较复杂,有普通氧化物(如Na2O)过氧化物(如Na2O2)还有超氧化物和臭氧化物等。因此要制备碱金属的普通氧化物一般是用碱金属还原对应的过氧化物、硝酸盐或亚硝酸盐。试用化学方程式表示以下反应:①钠与过氧化钠反应 。
②钾还原硝酸钾还产生了一种单质气体 。
⑵铝能从许多氧化物中夺取氧,利用铝的亲氧性除用于冶炼难熔金属外,还用于制取耐高温的金属陶瓷。例如将铝粉、石墨和二氧化钛按一定比例混和均匀,浮在金属表面上,然后在高温下煅烧,生成耐热的TiC,写出该反应的化学方程式 ??。
⑶将Al(OH)3和Na2CO3的混和物一同溶于氢氟酸可制得电解法炼铝必需的熔剂冰晶石(Na3AlF6),同时反应中产生一种无色无味的气体,试写出有关化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源:2012届安徽省高二下学期期末检测化学试卷 题型:选择题
对于第三周期元素的有关叙述错误的是
A.碱性:NaOH > Mg(OH)2 > Al(OH)3
B.电负性:Si < P < S
C.第一电离能:Na < Mg < Al
D.Cl-核外电子排布式:1s22s22p63s23p6
查看答案和解析>>
科目:高中化学 来源:09-10年泰州中学高二下学期期末考试化学卷 题型:选择题
对Na、Mg、Al的有关性质的叙述正确的是
A.碱性:NaOH< Mg(OH)2< Al(OH)3 B.第一电离能:Na< Mg <Al
C.电负性:Na> Mg >Al D.还原性:Na> Mg >Al
查看答案和解析>>
科目:高中化学 来源:北京模拟题 题型:填空题

 Bi(HDz)3+3H+],再经萃取把金属离子从水溶液中分离出来。设常温时该反应的化学平衡常数为K,则当pH=3时废水中c(H2Dz)等于________mol/L(用K表示)。
Bi(HDz)3+3H+],再经萃取把金属离子从水溶液中分离出来。设常温时该反应的化学平衡常数为K,则当pH=3时废水中c(H2Dz)等于________mol/L(用K表示)。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com