
【题目】下列有关实验操作、实验现象和所得结论均正确的是
实验操作 | 实验现象 | 结论 | |
A | 在2mL5%的H2O2溶液中加入1mL饱和FeCl3溶液 | 产生大量气泡 | Fe3+能催化H2O2的分解 |
B | 用0.100molL-1盐酸滴定未知浓度NaOH溶液(甲基橙做指示剂) | 溶液由橙色变红色,且在半分钟内不恢复 | 滴定到达终点 |
C | 向浓度均为0.1 mol·L-1NaCl 和NaI 混合溶液中滴加少量AgNO3溶液 | 产生黄色沉淀 | 溶度积: Ksp(AgCl)<Ksp(AgI) |
D | 往加有酚酞的碳酸钠溶液中加入足量的CaCl2溶液 | 产生白色沉淀,红色褪去 | 证明CO32-水解呈碱性 |
A. A B. B C. C D. D
【答案】D
【解析】A.氯化铁溶液中含有铁离子和氯离子,在2mL5%的H2O2溶液中加入1mL饱和FeCl3溶液,产生大量气泡,可能是氯离子的作用,不能证明Fe3+能催化H2O2的分解,故A 错误;B.用0.100molL-1盐酸滴定未知浓度NaOH溶液(甲基橙做指示剂) ,达到终点时生成物为氯化钠,溶液显中性,若溶液由橙色变红色,且在半分钟内不恢复,说明溶液显酸性,消耗标准液体积偏大,依据c(待测)= 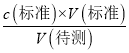 可知,NaOH溶液浓度偏大,故B错误;C.滴加少量AgNO3溶液,产生黄色沉淀,可知Ksp小的先沉淀,则Ksp(AgCl)>Ksp(AgI),故C错误;D.Na2CO3溶液水解显碱性,遇酚酞变红,加CaCl2溶液,水解平衡逆向移动,则证明Na2CO3溶液中存在水解平衡,故D正确;故选D。
可知,NaOH溶液浓度偏大,故B错误;C.滴加少量AgNO3溶液,产生黄色沉淀,可知Ksp小的先沉淀,则Ksp(AgCl)>Ksp(AgI),故C错误;D.Na2CO3溶液水解显碱性,遇酚酞变红,加CaCl2溶液,水解平衡逆向移动,则证明Na2CO3溶液中存在水解平衡,故D正确;故选D。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】(10分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4B. H2O2C. Cl2水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第23号元素钒在地壳中的含量大约为0.009%,在过渡元素中仅次于Fe、Ti、Mn、Zn,排第五位。我国四川攀枝花地区蕴藏着极其丰富的钒钛磁铁矿。
(1)钒在周期表中的位置为__________,电子占据的最高能层的轨道形状为__________。
(2)在地壳中含量最高的五种过渡金属元素Fe、Ti、Mn、Zn、V中,基态原子核外单电子数最多的是__________。
(3)过渡金属可形成许多羰基配合物,即CO作为配体形成的配合物。
①CO的等电子体有N2、CN-、__________(任写一个)等。
②CO作配体时,配位原子是C而不是O,其原因是__________。
(4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如[Fe(CO)5]、[Mn(CO)5]-等都满足这个规则。
①下列钒配合物中,钒原子满足18电子规则的是__________。
A.[V(H2O)6]2+ B.[V(CN)6]4- C.[V(CO)6]- D.[V(O2)4]3-
②化合物 的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“
的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“![]() ”中的大π键可表示为__________。
”中的大π键可表示为__________。
(5)VCl2(熔点1027 ℃)和VBr2(熔点827 ℃)均为六方晶胞,结构如图所示。

①VCl2和VBr2两者熔点差异的原因是__________。
②设晶体中阴、阳离子半径分别为r-和r+,该晶体的空间利用率为__________(用含a、c、r+和r-的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答有关问题:
(1)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。则H2S的平衡转化率为______%,反应平衡常数K=________。
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。则H2S的平衡转化率为______%,反应平衡常数K=________。
(2)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L1,溶液中的c(OH)=_________________ mol·L1。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=___________________。
)=___________________。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好沉淀完全(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为_______ mol·L1,此时溶液中c(CrO42)等于__________ mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的说法中,正确的是
A. 2mol/L盐酸与锌反应时,加入4mol/L的氯化钠溶液,生成氢气的速率加快
B. 对于可逆反应2CO+2NO![]() N2+2CO2,使用合适的催化剂,CO的生成速率和消耗速率都加快
N2+2CO2,使用合适的催化剂,CO的生成速率和消耗速率都加快
C. 工业上合成氨是放热反应,升高温度,正反应速率减慢
D. 在K2SO4和BaCl2两溶液反应时,增大压强,生成沉淀速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g)![]() 2HI(g),1molH2完全反应放出akJ热量。
2HI(g),1molH2完全反应放出akJ热量。
已知:
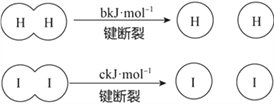 (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
A. 反应物的总能量高于生成物的总能量
B. 断开1molH-H键和1molI-I键所需能量大于断开2molH-I键所需能量
C. 断开2molH-I键所需能量约为(c+b+a)kJ
D. 向密闭容器中加入2molH2和2molI2,充分反应放出的热量大小2akJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com