
【题目】某烃的衍生物A,分子式为C6H12O2。实验表明A跟氢氧化钠溶液共热生成B和C,B跟盐酸反应生成有机物D,C在铜催化和加热条件下氧化为E,其中D、E都不能发生银镜反应。由此判断A的可能结构有
A.6种 B.4种 C.3种 D.2种
科目:高中化学 来源: 题型:
【题目】如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上均通过0.02mol电子,若不考虑溶液体积的变化,则下列叙述中正确的是( )
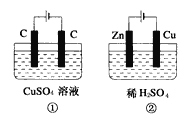
A. 产生气体的体积:(1)>(2)
B. 溶液PH的变化:(1)增大,(2)减小
C. 电极上析出物质的质量:(1)>(2)
D. 电极反应式:(1)中阳极:40H--4e-=2H2O+O2↑(2)中负极:2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应N2+3H2![]() 2NH3是工业上合成氨的重要反应。
2NH3是工业上合成氨的重要反应。

(1)根据图1请写出合成氨的热化学方程式_________________(热量用E1、E2或E3表示)。
(2)图1中虚线部分是通过改变化学反应中的________条件,该条件的改变与图2中哪一时刻条件的改变相同___________(用“t1……t6”表示)。
(3)t3时刻改变的条件是___________,t5时刻改变的条件是___________。
(4)某温度下,若把10 mol N2与30 molH2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则氮气的转化率____________。
(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 molN2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ;B中NH3的体积分数为b,放出热量Q2kJ。则:a__________b (填“>”、“<”或“=”,下同),Q1___________Q2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某溶液中加入含Fe2+的溶液后,无明显变化。当再滴入新制氯水后,混合溶液变成红色,则下列结论错误的是( )
A. 该溶液中一定含有SCN- B. 氧化性:Fe3+>Cl2
C. Fe2+与SCN-不能形成红色物质 D. Fe2+被氧化为Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓(Ga)与铝位于同一主族,金属镓的熔点是29. 8℃,沸点是2403℃,是一种广泛用于电子工业和通讯领域的重要金属。
(1)工业上利用镓与NH3在1000℃高温下合成固体半导体材料氮化镓(GaN),同时生成氢气,每生成lmol H2时放出10.27 kJ热量。
写出该反应.的热化学方程式___________________。
(2)在密闭容器中,充入一定量的Ga与NH3发生反应,实验测得反应平衡体系中NH3的体积分数与压强P和温度T的关系曲线如图1所示。

①图1中A点和C点化学平衡常数的大小关系是:KA_____ KC,(填“<”“=”或“>”),理由是____________。
②在T1和P6条件下反应至3min时达到平衡,此时改变条件并于D点处重新达到平衡,H2的浓度随反应时间的变化趋势如图2所示(34 min的浓度变化未表示出来),则改变的条件为________(仅改变温度或压强中的一种)。
(3)气相平衡中用组份的平衡分压(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),用含P6的式子表示B点的Kp=_____________。
(4)电解精炼法提纯嫁的具体原理如下:以粗镓(含Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH溶液为电解质,在电流作用下使粗镓溶解进入电解质溶液,并通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①已知离子氧化性顺序为:Zn2+3+2+2+。电解精炼镓时阳极泥的成分是________________。
②镓在阳极溶解生成的Ga3+与.NaOH溶液反应生成GaO2-,该反应的离子方程式为_________________;
GaO2-在阴极放电的电极反应式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的KI溶液、足量的CuSO4溶液和K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加32 g。据此回答问题: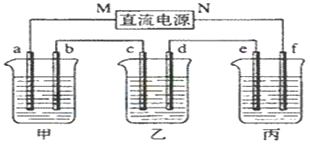
(1) 电源的N端为_________极;
(2) 电极b上发生的电极反应为____________________________________________;
(3) 电极f上生成的气体在标准状况下的体积_________________________________;
(4) 电解开始时,在甲烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是______________;
(5) 电解前后溶液的pH变化情况,(填增大、减小或不变)甲溶液___________;乙溶液_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示温度和压强对平衡状态下可逆反应2M(g)+N(g)![]() 2Q(g)ΔH<0的影响。下列有关说法正确的是(反应容器的体积不变)
2Q(g)ΔH<0的影响。下列有关说法正确的是(反应容器的体积不变)
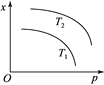
A. x可能表示该反应的平衡常数
B. x可能表示平衡混合物的密度
C. 当x表示Q的体积分数时,T2<T1
D. 当x表示平衡混合物的物质的量时,T2<T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能大量共存于同一溶液中的离子组是( )
A.Ba2+、K+、SO42— B.Ca2+、NO3—、Cl—
C.Na+、Mg2+、OH— D.H+、Cl—、HCO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛矿工业中会排放出酸性废水。含石TiO2+、Fe2+、Fe3+离子,其综合利用如下:

已知:TiO2+易水解,只能存在于强酸性溶液中。
(1)写出步骤Ⅰ发生反应的离子方程式___________。
(2)步骤Ⅰ后所得溶液中Fe2+的检验方法是___________。
(3)从溶液中得到FeSO4·7H2O的操作是___________、___________、过滤、洗涤。步骤Ⅲ中反应温度一般需控制在35℃以下,其目的是___________。
(4)步骤Ⅳ发生反应的化学方程式为___________。
(5)步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6mol·L-1。试判断所得的FeCO3中___________(填“有”或“没有”)(己知Fe(OH)2(已知Fe(OH)2的Ksp为8×10-16)
(6)向“富TiO2+溶液”中加入Na2CO3粉末得到固体TiO2·nH2O。请用化学原理解释其原因。___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com