
| A. | 7:5 | B. | 3:7 | C. | 7:1 | D. | 1:7 |
分析 先判断剩余的气体的成分,若为氧气,然后根据 4NO2+O2+2H2O=4HNO3计算,求出参加此反应的NO2和O2,最后相加得到原来的氧气,若剩余气体为NO,说明NO2过量,先根据3NO2+H2O=2HNO3+2NO求出过量的NO2,然后根据4NO2+O2+2H2O=4HNO3求出参加此反应的NO2和O2,最后相加得到原来的NO2.
解答 解:NO2和O2混合气体的试管倒立于水中发生反应:4NO2+O2+2H2O=4HNO3 最后剩余的1mL气体可能为氧气,也可能是NO气体,气体缩小的体积为:8mL-1mL=7mL,
若剩余气体为氧气,设参加4NO2+O2+2H2O=4HNO3 反应消耗的氧气为x,则有消耗的NO2为4x,即:5x=7mL,解得:x=1.4mL.则氧气的总量为:1.4mL+1mL=2.4mL,V(NO2)=8mL-2.4mL=5.6mL,原混合气体中NO2和O2的体积比为:5.6mL:1.4mL=4:1;
若剩余气体为NO气体,则有3NO2+H2O=2HNO3+NO,说明过量的NO2为1mL×3=3mL,反应4NO2+O2+2H2O=4HNO3消耗的气体总体积为8mL-3mL=5mL,设反应消耗的氧气为y,则有消耗的NO2为4y,则有:5y=5mL,y=1mL,即此时氧气为1mL,原来的NO2的总量V(NO2)=8mL-1mL=7mL,原混合气体中NO2和O2的体积比为:7mL:1mL=7:1,
故选C.
点评 本题主要考查了NO2、O2和H2O反应的计算,题目难度中等,需要明确反应4NO2+O2+2H2O=4HNO3中若过量的气体为NO2,但最后的剩余气体不是NO2,而是NO,原因是3NO2+H2O=2HNO3+2NO.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
在密闭容器中充入一定量的N02,发生反应2N02(g) N204(g) △H=一57kJ·mol—1。在温度为T1、T2时,平衡体系中N02的体积分数随压强变化的曲线如图所示。下列说法正确的是 ( )
N204(g) △H=一57kJ·mol—1。在温度为T1、T2时,平衡体系中N02的体积分数随压强变化的曲线如图所示。下列说法正确的是 ( )
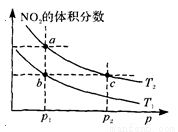
A.a、c两点的反应速率:a>c
B.a、b两点N02的转化率:a<b
C.a、c两点气体的颜色:a深,c浅
D.由a点到b点,可以用加热的方法
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀H2SO4 | B. | 稀HNO3 | C. | 浓H2SO4 | D. | 稀HCl(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 加入铝粉产生氢气的溶液:Na+、K+、SO42-、Cl- | |
| D. | $\frac{c{(H}^{+})}{c({OH}^{-})}$=1×1014的溶液:Ca2+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42-、NH4+能大量共存 | |
| B. | 常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存 | |
| C. | 一定温度下,l L 0.5 mol•L-1NH4Cl溶液与2 L 0.25 mol•L-1NH4Cl溶液含NH4+物质的量相同 | |
| D. | 反应ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq)说明Ksp(ZnS)>Ksp(CuS) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体的物质的量 | B. | 气体分子之间的平均距离 | ||
| C. | 气体分子本身的大小 | D. | 气体的种类A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=30mol•L-1•min-1 | B. | v(B)=0.3mol•L-1•s-1 | ||
| C. | v(C)=48mol•L-1•min-1 | D. | v(D)=1mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol CH4含有的电子数为NA | |
| B. | 标准状况下,22.4L己烷中共价键数为19NA | |
| C. | 6.4g CaC2固体中所含阴离子数为0.2NA | |
| D. | 1L 1mol/L的NaHCO3溶液中含有NA个HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com