
| A. | 随着碳原子数的增多,一氯代烃的沸点逐渐升高 | |
| B. | 随着碳原子数的增多,一氯代烃的密度逐渐增大 | |
| C. | 等碳原子数的一氯代烃,支链越多,沸点越低 | |
| D. | 等碳原子数的一卤代烃,卤素的原子序数越大,沸点越高 |
分析 A、碳原子数越多,一氯代烃的相对分子质量越大,从而影响到分子间作用力;
B、碳原子数越多,一氯代烃的相对分子质量越大,从而影响到密度大小;
C、等碳原子数的一氯代烃,支链越多,则挥发越容易;
D、氟代烃分子间会存在氢键.
解答 解:A、碳原子数越多,一氯代烃的相对分子质量越大,从而分子间作用力越大,则沸点越高,故A正确;
B、碳原子数越多,一氯代烃的相对分子质量越大,则密度越大,故B正确;
C、等碳原子数的一氯代烃,支链越多,则挥发越容易,即沸点越低,故C正确;
D、氟代烃分子间会存在氢键,故一氟代烃是一卤代烃中沸点最高的,即并不是卤素原子的序数越大,沸点越高,故D错误.
故选D.
点评 本题考查了卤代烃的物理性质随着碳原子数的递增或卤素原子序数的递增而递变的规律,难度不大,应注意氢键的存在对沸点的影响.


科目:高中化学 来源: 题型:选择题
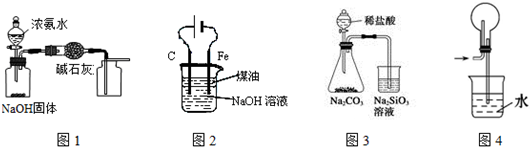
| A. | 用图1装置制取干燥纯净的NH3 | |
| B. | 用图2装置制备Fe(OH)2并能较长时间观察其颜色 | |
| C. | 装置3可证明非金属性Cl>C>Si | |
| D. | 装置4用于HCl的吸收,防止倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 过硫酸:
过硫酸: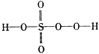
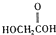 (b)
(b)  (c) H2O2 (d)
(c) H2O2 (d) 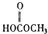
 (f)
(f)  (g) O2 (h)
(g) O2 (h) 
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序:r(Y)>r(Z)>r(W)>r(M) | |
| B. | 由三种元素X、Z、W形成的化合物中只有共价键而无离子键 | |
| C. | Z的气态氢化物比W的气态氢化物更稳定 | |
| D. | 分子式为Y4X8W2的物质超过10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铯的密度比钠大,熔点比钠高 | |
| B. | 氢氧化铯易溶于水 | |
| C. | 铯能与热水反应放出氢气,但与冷水不反应 | |
| D. | 铯与氯形成共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

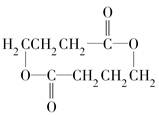 ;
;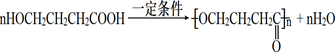 或
或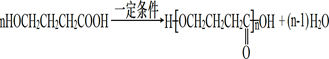 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
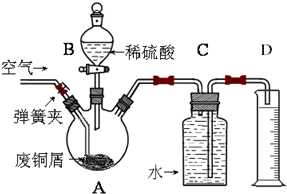
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴极:2H++2e-═H2↑ 阳极:4OH--4e-═O2↑+2H2O | |
| B. | 阴极:Cu2++2e-═Cu 阳极:4OH--4e-═O2↑+2H2O | |
| C. | 阴极:2H++2e-═H2↑ 阳极:2C1--2e-═Cl2↑ | |
| D. | 阴极:Cu2++2e-═Cu 阳极:2C1--2e-═Cl2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com