
【题目】运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:
(1)请配平以下化学方程式:
Al+NaNO3+NaOH=NaAlO2+N2↑+H2O
若反应过程中转移5mol电子,则生成标准状况下N2的体积为L.
(2)25℃时,将a molL﹣1的氨水与0.1molL﹣1的盐酸等体积混合,当溶液中离子浓度关系满足c(NH4+)>c(Cl﹣)时,则反应的情况可能为 .
a.盐酸不足,氨水剩余b.氨水与盐酸恰好完全反应c.盐酸过量
(3)向NH4HSO4溶液中滴加少量的Ba(OH)2溶液的离子方程式 .
(4)25℃,两种酸的电离平衡常数如表.
Ka1 | Ka2 | |
H2SO3 | 1.3×10﹣2 | 6.3×10﹣8 |
H2CO3 | 4.2×10﹣7 | 5.6×10﹣11 |
①HSO3﹣的电离平衡常数表达式K= .
②0.10molL﹣1Na2SO3溶液中离子浓度由大到小的顺序为 .
③H2SO3溶液和NaHCO3溶液混合,主要反应的离子方程式为 .
【答案】
(1)10;6;4;10;3;2;11.2
(2)a
(3)2H++SO42﹣+Ba2++2OH﹣=BaSO4+2H2O
(4)![]() ;c(Na+)>c(SO32﹣)>c(OH﹣)>c(HSO3﹣)>c(H+);H2SO3+HCO3﹣=HSO3﹣+CO2↑+H2O
;c(Na+)>c(SO32﹣)>c(OH﹣)>c(HSO3﹣)>c(H+);H2SO3+HCO3﹣=HSO3﹣+CO2↑+H2O
【解析】解:(1)在反应Al+NaNO3+NaOH=NaAlO2+N2↑+H2O中,铝元素从0价变为+3价,氮从+5价变为0价,根据电子得失守恒可知,Al的系数为10,NaNO3的系数为6,NaAlO2的系数为10,N2的系数为3,根据钠元素守恒可知,NaOH的系数为4,根据氢元素守恒可知,H2O的系数为2,所以反应方程式为10Al+6 NaNO3+4 NaOH=10NaAlO2+3N2↑+2H2O,该反应中每生成3mol氮气,转移的电子数目为30mol,所以反应过程中转移5mol e﹣ , 则生成标准状况下N2的物质的量为0.5mol,其体积为11.2L,所以答案是:10、6、4、10、3、2; 11.2;(2)溶液中离子浓度关系满足c(NH4+)>c(Cl﹣)时,由电荷守恒可知c(H+)<c(OH﹣),溶液呈碱性,
a.盐酸不足,氨水剩余,为氯化铵与氨水的混合溶液,铵根离子水解程度小于氨水的电离时,溶液可能呈碱性,故a可能;
b.氨水与盐酸恰好完全反应,为氯化铵溶液,铵根离子水解,溶液呈酸性,故b不可能;
c.盐酸过量,溶液为氯化铵、盐酸的混合溶液,溶液呈酸性,故c不可能;
故选:a;(3)向NH4HSO4溶液中滴加少量的Ba(OH)2溶液,则氢氧根离子少量只与氢离子反应,所以离子方程式为:2H++SO42﹣+Ba2++2OH﹣=BaSO4+2H2O,所以答案是:2H++SO42﹣+Ba2++2OH﹣=BaSO4+2H2O;(4)①HSO3﹣的电离方程式为:HSO3﹣H++SO32﹣ , 平衡常数表达式为K= ![]() ;
;
所以答案是: ![]() ;
;
②Na2SO3溶液显碱性,SO32﹣存在两步水解:SO32﹣+H2OHSO3﹣+OH﹣ , HSO3﹣+H2OH2SO3+OH﹣ , 以第一步水解为主,水解程度较小,则0.1mol/L Na2SO3溶液中的离子浓度顺序为:c(Na+)>c(SO32﹣)>c(OH﹣)>c(HSO3﹣)>c(H+),所以答案是:c(Na+)>c(SO32﹣)>c(OH﹣)>c(HSO3﹣)>c(H+);
③由表可知H2SO3的二级电离小于H2CO3的一级电离,所以酸性强弱H2SO3>H2CO3>HSO3﹣ , 所以反应的主要离子方程式为H2SO3+HCO3﹣=HSO3﹣+CO2↑+H2O,而不是为H2SO3+2HCO3﹣=SO32﹣+2CO2↑+2H2O,
所以答案是:H2SO3+HCO3﹣=HSO3﹣+CO2↑+H2O.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】Ⅰ.已知2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑
(1)氧化剂与还原剂的物质的量之比是_________,HCl在反应中表现的性质有____________。
(2)单线桥标明该反应电子转移方向和数目:________________________。
(3)写出以软锰矿为原料制备Cl2的化学方程式___________________。
Ⅱ.(1)VLFe2(SO4)3溶液中含Fe3+ag,则该溶液中溶质的物质的量浓度为______________。
(2)为了供学生课外活动,要求把SO42-、CO32-、H+、OH-、NH4+、Fe3+、Na+七种离子根据共存原理分为两组混合溶液,分配结果是:
第一组:_______________;第二组:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( ) 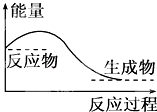
A.任何化学反应都伴随着能量的变化
B.H2O(g)═H2O(l)该过程放出大量的热,所以该过程是化学变化
C.化学反应中能量的变化都表现为热量的变化
D.对于如图所示的过程,是吸收能量的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠及其化合物的说法中正确的是( )
A.将2.3 g Na投入到97.7 g水中充分反应,所得溶液的质量分数为4.0%
B.相同质量的铝分别与足量的盐酸和NaOH溶液反应,生成气体物质的量之比为1:3
C.将CO2和H2O的混合气体a mol,与足量的Na2O2固体充分反应,生成的O2在标准状况下的体积为11.2a L
D.120 mL含有0.20 mol碳酸钠的溶液与200 mL盐酸进行滴加反应,不管将前者滴入后者,还是后者滴入前者,滴加完全后,产生的气体在相同条件下体积不等,则盐酸的浓度可能为2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A,B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25molL﹣1min﹣1 , 下列说法正确的是( )
A.反应速率v(B)=0.25 molL﹣1min﹣1
B.该反应方程式中,x=1
C.2min时,A的物质的量为1.5mol
D.2min时,A的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、碳、氮、氟、硫、铁等元素的化合物广泛存在于自然界,回答下列问题:
(1)基态铁原子的外围电子排布式为;Fe3+比Fe2+稳定的原因是 .
(2)第二周期中,元素的第一电离能处于B与N之间的元素有种.
(3)NF3是微电子工业中优良的等离子刻蚀气体,NF3分子的空间构型为;在NF3中,N原子的杂化轨道类型为 .
(4)与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为 , 层间作用力为 .
(5)S和Fe形成的某化合物,其晶胞如图所示,则该物质的化学式为 . 假设该晶胞的密度为ρ g/cm3 , 用NA表示阿伏加德罗常数,则该晶胞中距离最近的S原子之间的距离为(列出计算式即可)cm. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将amol小苏打和bmol过氧化钠置于某体积可变的密闭容器中充分加热,反应后测得容器内的氧气为1mol,下列说法一定正确的是( )
A.b=2
B.容器中一定没有残余的CO2和水蒸气
C.a:b≥1
D.反应中转移的电子数一定为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com