
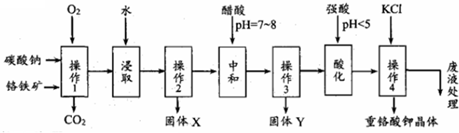
分析 铬铁矿、碳酸钠固体通过在氧气中焙烧,生成Na2CrO4、Fe2O3、Na2SiO3、MgO和NaAlO2的混合固体和二氧化碳气体,所以操作1为焙烧,然后加水浸取,过滤得固体Fe2O3、MgO和溶液Na2CrO4、NaAlO2、Na2SiO3,操作2为过滤,固体X为Fe2O3、MgO,再调节溶液的PH到7-8,使偏铝酸盐生成氢氧化铝沉淀,硅酸钠变为硅沉淀,所以固体Y为Al(OH)3、H2SiO3,继续调节溶液的PH使CrO42-转化为Cr2O72-,最后向所得溶液中加入氯化钾,生成溶解度极小的K2Cr2O7,
(1)根据影响反应速率的外界因素可知,升高温度、增大反应物接触面积等都可以增大反应速率;
(2)根据上面的分析可知,固体Y的成份;
(3)结合流程图可知,酸化为了转化CrO42-离子为Cr2O72-,据此书写离子方程式;
(4)操作4是向含Cr2O72-的溶液中加入氯化钾,生成溶解度极小的K2Cr2O7,由易溶物生成难溶物;从K2Cr2O7溶液中获得晶体,要将溶液蒸发浓缩到有少量晶体析出再冷却结晶,据此答题;
(5)根据实验步骤可知,用碘化钾Cr2O72-将还原成Cr3+,根据电子得失守恒有关系式Cr2O72-~3I2,再用Na2S2O3标准溶液滴定( I2+2S2O32-═2I-+S4O62-),根据Na2S2O3的物质的量可计算出样品中K2Cr2O7的物质的量,进而确定样品中K2Cr2O7的纯度;
(6)A.粗产品中可能含有氯化钠杂质,所以若要进一步提纯,可以用重结晶的方法;
B.配制溶液时,用托盘夭平称取试样后,一般经溶解、转移(含洗涤)、定容、摇匀等步骤,配制成100mL溶液;
C.滴定时,用Na2S2O3滴定I2,滴定终点时溶液由蓝色变为无色;
D.滴定终点时俯视读数,测定结果偏低,读取的标准液体积偏小.
解答 解:(1)操作1中为使反应速率增大,可采取的两条措施是升高温度、将原料粉碎(或使用催化剂),
故答案为:升高温度、将原料粉碎(或使用催化剂);
(2)根据上面的分析可知,固体Y的成份为Al(OH)3、H2SiO3,
故答案为:Al(OH)3、H2SiO3;
(3)结合流程图可知,酸化为了转化CrO42-离子为Cr2O72-,反应的离子方程式为2CrO42-+2H+=Cr2O72-+H2O,
故答案为:2CrO42-+2H+=Cr2O72-+H2O;
(4)操作4是向含Cr2O72-的溶液中加入氯化钾,生成溶解度极小的K2Cr2O7,所以该反应在溶液中能发生的可能理由是在该条件下,K2Cr2O7的溶解度较小,从K2Cr2O7溶液中获得晶体,要将溶液蒸发浓缩到有少量晶体析出再冷却结晶,
故答案为:该条件下,K2Cr2O7的溶解度较小;溶液表面出现晶膜(或溶液中析出固体);
(5)根据实验步骤可知,用碘化钾Cr2O72-将还原成Cr3+,根据电子得失守恒有关系式Cr2O72-~3I2,再用Na2S2O3标准溶液滴定( I2+2S2O32-═2I-+S4O62-),所以有关系式Cr2O72-~3I2~6S2O32-,Na2S2O3的物质的量为0.1500mol/L×36.00mL=5.4×10-3 mol,所以样品中K2Cr2O7的物质的量$\frac{1}{6}$×5.4×10-3 mol×$\frac{100mL}{25mL}$=3.6×10-3 mol,样品中K2Cr2O7的纯度为$\frac{3.6×10{\\;}^{-3}mol×294g/mol}{1.470g}$×100%=72%,
故答案为:72%;
(6)A.粗产品中可能含有氯化钠杂质,所以若要进一步提纯,可以用重结晶的方法,故A正确;
B.配制溶液时,用托盘夭平称取试样后,一般经溶解、转移(含洗涤)、定容、摇匀等步骤,配制成100mL溶液,故B错误;
C.滴定时,用Na2S2O3滴定I2,滴定终点时溶液由蓝色变为无色,故C错误;
D.滴定终点时俯视读数,测定结果偏低,读取的标准液体积偏小,所以测得的结果偏低,故D正确,
故选AD.
点评 本题考查了物质制备流程和方案的分析判断,物质性质的应用,准确对题干信息的分析理解,操作步骤的注意问题和基本操作方法是解题关键,对学生综合能力的考查要求较高,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、石膏、铁红 | B. | 醋酸、烧碱、纯碱、生石灰 | ||
| C. | 碳酸、熟石膏、小苏打、三氧化硫 | D. | 氯化氢、苛性钠、氯化钠、石灰石 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据物质能否导电将物质分为电解质和非电解质 | |
| B. | 根据反应中的热效应将化学反应分为放热反应和吸热反应 | |
| C. | 根据溶液导电性强弱将电解质分为强电解质和弱非电解质 | |
| D. | 根据元素的化合价的高低将化学反应分为氧化还原反应和非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=1 | |
| B. | B的转化率为80% | |
| C. | 2min内A的平均反应速率为0.3 mol•(L•min)-1 | |
| D. | 若混合气体的密度不变,也不能明该反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
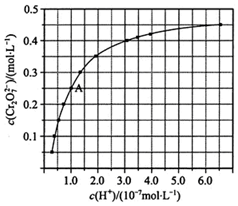 (1)CrO42-和Cr2O72-在溶液中可相互转化.室温下,初始浓度为1.0mol•L-1的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示.
(1)CrO42-和Cr2O72-在溶液中可相互转化.室温下,初始浓度为1.0mol•L-1的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①③④⑤ | C. | ①③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
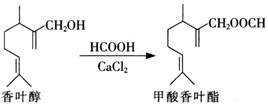
| A. | 香叶醇分子中含有1个手性碳原子 | |
| B. | 香叶醇可发生消去、加成、氧化反应 | |
| C. | 1 mol甲酸香叶酯可以与1molNaOH反应 | |
| D. | 甲酸香叶酯分子中所有碳原子均可能共平面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com