
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.104 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A. | E2-与B3+的核外电子数不可能相等 | |
| B. | 离子半径大小A+<E2- | |
| C. | 最高价氧化物对应水化物的碱性A<C | |
| D. | 氢化物的稳定性H2D>H2E |
分析 短周期元素,由元素的化合价可知,D、E都有-2价,而D有+6价且原子半径较大,则D为S元素、E为O元素;A、B、C化合价分别为+1、+3、+2,则分别处于IA族、ⅢA族、ⅡA族,C的原子半径小于硫,故C为Be元素,原子半径A、B均大于硫,则B为Al元素,且A、B原子半径相差较大,故A为Na,结合元素周期律解答.
解答 解:短周期元素,由元素的化合价可知,D、E都有-2价,而D有+6价且原子半径较大,则D为元素、E为O元素;A、B、C化合价分别为+1、+3、+2,则分别处于IA族、ⅢA族、ⅡA族,C的原子半径小于硫,故C为Be元素,原子半径A、B均大于硫,则B为Al,且A、B原子半径相差较大,故A为Na.
A.B为Al元素,E为O元素,O2-与Al3+的核外电子数均为10,故A错误;
B.核外电子排布相同的离子,原子序数越大,离子半径越小,则离子半径大小Na+<O2-,故B正确;
C.元素的金属性越强,其最高价氧化物对应水化物的碱性越强,则最高价氧化物对应水化物的碱性A>C,故C错误;
D.非金属性S<O,则气态氢化物的稳定性H2S<H2O,故D错误,
故选:B.
点评 本题考查结构性质位置关系应用,题目难度中等,解决本题的关键是根据化合价与原子半径推断元素,侧重于考查学生的分析能力和对基础知识的综合应用能力.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 试剂或试验方法 | 说明 |
| A | 从苯中提溴 | 加CCl4 | 溴易溶于CCl4 |
| B | 检验含Fe3+溶液中是否含Fe2+ | 加高锰酸钾溶液 | 溶液紫色褪去,说明含Fe2+ |
| C | 配置1mol/LFeCl3溶液100mL | 将一定质量FeCl3溶液转移至容量瓶中加水定容 | 容量瓶规格须为100mL |
| D | 制取漂白粉 | 将氯气通入澄清石灰水中 | 氯气与氢氧化钙反应生成次氯酸钙 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定管和锥形瓶在使用前要用润洗 | |
| B. | 检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 | |
| C. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出 | |
| D. | 将CO2和SO2混合气体分别通入BaC12溶液、Ba(NO3)2溶液中,最终都有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量时,将NaOH固体放在右盘内的纸上,称得质量为10.2g | |
| B. | 用25mL碱式滴定管量取高锰酸钾溶液,体积为16.60mL | |
| C. | 用干燥的广泛pH试纸测稀盐酸的pH=3.2 | |
| D. | 用10mL量筒量取NaCl溶液,体积为9.2mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+ Fe2+ | B. | H+ | C. | Cu2+ Fe3+ | D. | Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的变化过程,上述两个反应属于水解反应 | |
| B. | 丹参素结构如图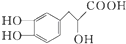 所示,能发生取代、加成、氧化反应 所示,能发生取代、加成、氧化反应 | |
| C. | 乙烯含双键,可使酸性KMnO4溶液褪色,而乙醇中只含单键不能使酸性高锰酸钾溶液褪色 | |
| D. | 回收地沟油,水解制氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
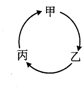 下表所列各组物质中,物质之间不能通过一步反应实现如图所示转化的是
下表所列各组物质中,物质之间不能通过一步反应实现如图所示转化的是| 选项、物质 | 甲 | 乙 | 丙 |
| A | SO2 | SO3 | H2SO4 |
| B | NH4Cl | NH3 | NO |
| C | Na | NaOH | NaCl |
| D | Al2O3 | AlCl3 | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
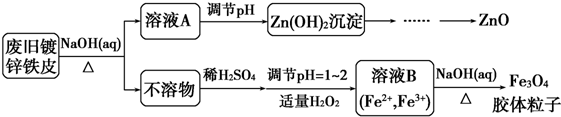
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com