
 .
.
 ;
;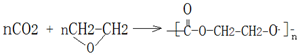 .
.分析 物质A能发生银镜反应,A、B、D、E、F、G为有机小分子,H、I为高分子,它们之间存在如下转化关系(部分反应条件及产物未列出),D是石油裂解气的主要成分,则D为CH2=CH2,根据各物质的转化关系,甘蔗渣处理之后得到纤维素,纤维素水解的最终产物为A为葡萄糖,葡萄糖在酒化酶的作用下生成B为CH3CH2OH,C为CO2,乙烯与CO、水反应生成F为CH2=CHCOOH,B与F在浓硫酸条件下反应生成G为CH2=CHCOOCH2CH3,G发生加聚反应生成H为 ,E的结构为
,E的结构为 ,C为CO2,E和C反应生成I为
,C为CO2,E和C反应生成I为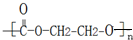 ,结合题目分析解答;
,结合题目分析解答;
解答 解:物质A能发生银镜反应,A、B、D、E、F、G为有机小分子,H、I为高分子,它们之间存在如下转化关系(部分反应条件及产物未列出),D是石油裂解气的主要成分,则D为CH2=CH2,根据各物质的转化关系,甘蔗渣处理之后得到纤维素,纤维素水解的最终产物为A为葡萄糖,葡萄糖在酒化酶的作用下生成B为CH3CH2OH,C为CO2,乙烯与CO、水反应生成F为CH2=CHCOOH,B与F在浓硫酸条件下反应生成G为CH2=CHCOOCH2CH3,G发生加聚反应生成H为 ,E的结构为
,E的结构为 ,C为CO2,E和C反应生成I为
,C为CO2,E和C反应生成I为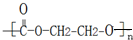 ,
,
(1)F为CH2=CHCOOH,F中所含官能团的名称为碳碳双键、羧基,A为葡萄糖,A的分子式 C6H12O6,根据上面的分析可知,反应④的反应类型为加聚反应,
故答案为:碳碳双键、羧基;C6H12O6;加聚反应;
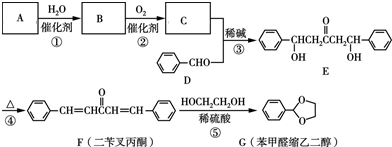
(2)反应③的化学方程式为 ,
,
故答案为: ;
;
(3)C和E在一定条件下可生成一种可降解的高聚物的方程式为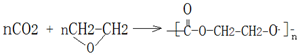 ,
,
故答案为: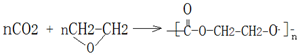 ;
;
(4)G为CH2=CHCOOCH2CH3,根据条件①链式结构且分子中不含甲基,②能与NaHCO3溶液反应产生CO2,说明有羧基,则符合条件的G的同分异构体的结构简式为CH2=CHCH2CH2COOH,
故答案为:CH2=CHCH2CH2COOH.
点评 本题考查有机物推断,为高频考点,正确推断各物质结构简式是解本题关键,注意结合题给信息、反应条件进行推断,知道常见有机物官能团及其性质关系,难点是(5)题同分异构体种类判断,要考虑官能团位置异构、碳链异构,题目难度中等.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
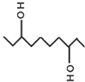
| A. | 该有机物的分子式为C10H20O2 | |
| B. | 该有机物与乙二醇、甘油互为同系物 | |
| C. | 1mol该有机物一定条件下与Na完全反应最多可生成22.4L氢气 | |
| D. | 该有机物一定条件下,可以发生取代、氧化、酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 丙中一定含有羧基 | B. | 甲不可以与HBr发生取代反应 | ||
| C. | 甲、乙、丙都能发生氧化反应 | D. | 可以用溴水检验乙中的碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2015年诺贝尔化学奖颁给了研究细胞修复自身DNA机制的三位科学家.DNA属于有机高分子,化学家鲍林(L.Pauling)提出的氢键理论和蛋白质分子的螺旋结构模型,为DNA分子双螺旋结构模型的提出奠定了基础 | |
| B. | 生物炼铜是指铜矿石在细菌作用下可把不溶性的硫化铜转化为可溶性铜盐,使铜的冶炼变得简单 | |
| C. | 埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液、双氧水均可以将病毒氧化而达到消毒的目的 | |
| D. | 扫描隧道显微技术、超分辨荧光显微技术等的发展促进了人类对微观结构的探索,可实现对原子或分子的操控,使科学研究迈入更高的水平层次 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
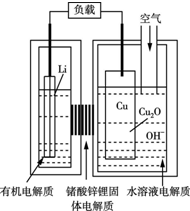 近年来科学家正在研制一种高容量、低成本锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH─,下列说法不正确的是( )
近年来科学家正在研制一种高容量、低成本锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH─,下列说法不正确的是( )| A. | 放电时,电子通过固体电解质向Cu极移动 | |
| B. | 通空气时,铜被腐蚀,表面产生Cu2O | |
| C. | 放电时,正极的电极反应式为Cu2O+H2O+2e─=2Cu+2OH─ | |
| D. | 整个反应过程中,铜相当于催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +2
+2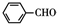 $\stackrel{碱}{→}$
$\stackrel{碱}{→}$ .
.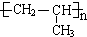 .
.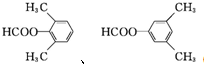 .
.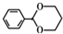 (无机物任选).
(无机物任选).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
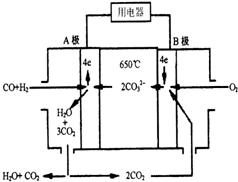 现有一个碳酸盐燃料电池,以一定比例的Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,直接以水煤气(CO、H2的体积比为1:1)为燃料,其工作原理如图所示.
现有一个碳酸盐燃料电池,以一定比例的Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,直接以水煤气(CO、H2的体积比为1:1)为燃料,其工作原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
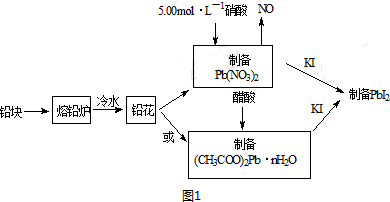
| 实验内容 | 实验方法 | 实验现象及原因分析 |
| ①碘离子浓度增大对平衡的影响 | 取PbI2饱和溶液少量于一支试管中,再滴入几滴NaI饱和溶液 | 现象:溶液中c(I-)增大,使Q大于了PbI2的Ksp |
| ②铅离子浓度减小对平衡的影响 | 取PbI2悬浊液少量于一支试管中,再加入少量NaCl饱和溶液 | 现象:黄色浑浊消失 原因:形成PbCl42-,导致溶液中c(Pb2+)减小,使Qc小于PbI2的Ksp |
| ③铅离子和碘离子浓度都减小对平衡的影响 | 在PbI2悬浊液中滴入几滴FeCl3饱和溶液 | 现象:黄色浑浊消失 写出反应的离子方程式:PbI2+2Fe3++4Cl-=PbCl42-+2Fe2++I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com