
【题目】实验室需要配制0.1mol/LNaOH溶液480mL,下列叙述正确的是( )
A.需要用托盘天平称量NaOH固体的质量为1.92g
B.将NaOH固体在小烧杯中加水溶解后立即倒入容量瓶中并进行定容
C.在容量瓶中定容时俯视容量瓶刻度线会使溶液浓度偏高
D.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
【答案】C
【解析】解:A.需要配制0.1mol/LNaOH溶液480mL,实验室没有480mL容量瓶,应选择500mL容量瓶,需要氢氧化钠的质量m=0.1mol/L×40g/mol×0.5L=2.0g,故A错误;B.容量瓶为精密仪器,不能用来盛放过热液体,氢氧化钠溶解释放大量的热,应冷却到室温再进行移液操作,故B错误;
C.在容量瓶中定容时俯视容量瓶刻度线,导致溶液体积偏小,依据C= ![]() 可知溶液浓度偏高,故C正确;
可知溶液浓度偏高,故C正确;
D.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,导致溶液体积偏大,依据C=nV可知溶液浓度偏低,故D错误;
故选:C.
需要配制0.1mol/LNaOH溶液480mL,实验室没有480mL容量瓶,应选择500mL容量瓶,实际配制500mL溶液,依据m=CVM计算需要溶质的质量,结合容量瓶使用方法及依据C= ![]() 进行误差分析,即可解答.
进行误差分析,即可解答.


科目:高中化学 来源: 题型:
【题目】下面有关Na2CO3与NaHCO3的性质比较中错误的是( )
A.相同浓度溶液的碱性:Na2CO3>NaHCO3
B.在水中的溶解度:Na2CO3>NaHCO3
C.与同浓度的硫酸反应放出气泡的速率:NaHCO3<Na2CO3
D.热稳定性:NaHCO3<Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸是一种强酸,氯酸的浓度超过40%就会迅速分解,反应的化学方程式为:8HClO3═3O2↑+2Cl2↑+4HClO4+2H2O.根据题意完成下列小题:
①在上述变化过程中,发生还原反应的过程是→(填化学式).
②该反应的氧化产物是(填化学式);求所得混合气体的平均相对分子质量 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学实验的操作或说法中,正确的是( )
A.苯酚中滴加少量的稀溴水出现了三溴苯酚的白色沉淀
B.检验C2H5Cl中氯原子时,将C2H5Cl和NaOH溶液混合加热后,加入稀硫酸进行酸化
C.用无水乙醇和浓H2SO4共热至140℃可以制得乙烯气体
D.制取溴苯应用液溴、铁屑和苯混合,反应后并用稀碱液洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为教科书中电解饱和食盐水的实验装置.据此,下列叙述不正确的是( ) 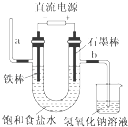
A.装置中,a管能产生氢气
B.在石墨棒电极区域有NaOH产物
C.b管导出的是氯气
D.以食盐水为基础原料制取氯气等产品的工业称为“氯碱工业”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸混合溶液200mL,平均分成甲、乙两份。向甲中逐渐加入铜粉,最多能溶解9.6克,向乙中逐渐加入铁粉,产生气体的量随铜粉质量的变化如下图所示(已知:Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O)。下列分析结果不正确的是( )
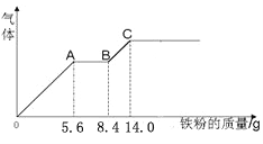
A. 原混合溶液中NO3一的物质的量浓度为4mol/L
B. AB段的反应为:Fe+2Fe3+=3Fe2+
C. C点时,乙中溶质为FeSO4
D. 标准状况下,OA、BC段产生的气体总体积约为4.48L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在298K时下述反应的有关数据:
C(s)+ ![]() O2(g)=CO(g)△H1=﹣110.5kJ/mol
O2(g)=CO(g)△H1=﹣110.5kJ/mol
C(s)+O2(g)=CO2(g),△H2=﹣393.5kJ/mol
则C(s)+CO2(g)=2CO(g)的△H 为( )
A.283.5kJ/mol
B.172.5kJ/mol
C.﹣172.5kJ/mol
D.﹣504 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.常温下,0.1mol Fe与酸完全反应时,失去的电子数一定为0.3NA
B.0.1mol/L的 CaCl2溶液中所含Cl﹣数为0.2NA
C.7.8g Na2O2与足量水反应,转移电子数为0.2NA
D.常温常压下,8g CH4含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H=﹣890.3kJmol﹣1
②2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJmol﹣1
③C(s)+O2(g)═CO2(g)△H=﹣393.5Kjmol﹣1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷气体与O2作用而产生的能量存活,甲烷细菌使1mol甲烷生成CO2气体与液态水,放出的能量(填“>”、“<”或“=”)890.3kJ.
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2═2CO+2H2 , 1g CH4完全反应可释放15.46kJ的热量,则:
①图1(所有物质均为气态)能表示该反应过程中能量变化的是(填字母).
②若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随时间的变化如图2所示,则CH4的转化率为 .
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)═CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)═CH4(g)的反应热△H= .
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是(填字母).
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2 , 并放出热量
B.将固态碳合成为C60 , 以C60作为燃料
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com