

| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的试剂:a.NaOH b.H2O2 c.Na2CO3 d.CuO | ||


科目:高中化学 来源: 题型:
| A、氧化性:F2>C12>Br2 |
| B、酸性:HClO4>H2SO4>H3PO4 |
| C、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| D、热稳定性:SiH4>PH3>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O、HCOOH、(NH4)2Fe(SO4)2均含有氧,都是氧化物 |
| B、HCl、H2SO4、HNO3均具有氧化性,都是氧化性酸 |
| C、赤铁矿、磁铁矿、黄铁矿、孔雀石都是常见的铁矿石 |
| D、Na2CO3、Ba(OH)2、NH4Cl、Na2O2都属于离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 ,芳香烃A的分子式为C8H10,在一定条件下能发生下列转化,B、H属同系物,J是一种常见的高分子塑料.
,芳香烃A的分子式为C8H10,在一定条件下能发生下列转化,B、H属同系物,J是一种常见的高分子塑料.
查看答案和解析>>
科目:高中化学 来源: 题型:
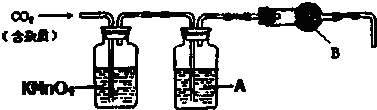
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

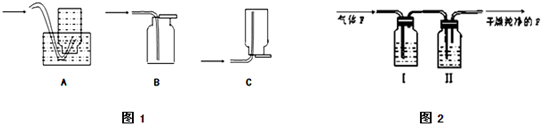
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、1molX最多能与2molBr2发生取代反应 |
| B、Y分子结构中有2个手性碳原子 |
| C、Y能发生加成、取代、消去、氧化、缩聚反应 |
| D、1mol Z最多能与7molNaOH发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com