
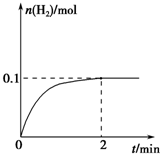
 硫-碘循环分解水制氢主要涉及下列反应:
硫-碘循环分解水制氢主要涉及下列反应:| 实际生成量 |
| 理论生成量 |
| 0.1mol |
| 1L |
| 0.1mol/L |
| 2min |
| c(H2)c(I2) |
| c2(HI) |
| 0.1×0.1 |
| 0.82 |
| 1 |
| 64 |
| 572KJ |
| 2 |
| 实际生成量 |
| 理论生成量 |
| 228.8KJ |
| 286KJ |


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| V |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、砹易溶于某些有机溶剂 |
| B、砹化氢很不稳定易分解 |
| C、砹是有色气体 |
| D、砹化银不溶于水或稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图中X为电源,Y为浸透饱和硫酸钠溶液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散,下列判断正确的是( )
如图中X为电源,Y为浸透饱和硫酸钠溶液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散,下列判断正确的是( )| A、c电极的电极反应式为:2H++2e-=H2↑ |
| B、Cu电极质量减小,Pt电极质量增大 |
| C、Z中溶液的pH先减小,后增大 |
| D、a为电源正极,b为电源负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铁、硫酸铜、硫酸 |
| B、氢氟酸、空气、纯碱 |
| C、硝酸、胆矾、熟石灰 |
| D、醋酸、食盐水、烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合金材料中可能含有非金属元素 |
| B、酒精有消毒杀菌作用,医用酒精浓度越大杀菌效果越好 |
| C、地沟油含有有害物质,不能进行加工制生物柴油 |
| D、目前我市的汽油标准已由“国Ⅲ”提到“国Ⅳ”,这意味着汽车不再排放氮的氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com