
| A. | 铁表面镀锌可增强其抗腐蚀性 | |
| B. | 二氧化硅是将太阳能转变为电能的常用材料 | |
| C. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 | |
| D. | 酒精能使蛋白质变性,可用于杀菌消毒 |
分析 A.铁表面镀锌,可起到防护作用;
B.单质硅可用于制作太阳能电池的原料;
C.浓盐酸易挥发,与NH3结合生成NH4Cl固体;
D.酒精能使蛋白质变性而杀菌消毒;
解答 解:A.铁表面镀锌,可起到防护作用,如表面破损,锌比铁活泼,锌为负极,也能起到防护作用,故A正确;
B.单质硅可用于制作太阳能电池的原料,太阳能电池可将太阳能转化为电能,二氧化硅是光导纤维的成分,故B错误;
C.浓盐酸易挥发,与NH3结合生成NH4Cl固体小颗粒,为白烟,所以可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气,故C正确;
D.在75%的酒精作用下,乙醇能渗入细胞内,使蛋白质凝固变性,从而起到杀菌的作用,故D正确;
故选B.
点评 本题考查了常见生活环境的污染与治理、金属的腐蚀与防护、氨气的检验以及酒精的杀毒原理等问题,难度一般.


科目:高中化学 来源: 题型:推断题
| A | B | ||
| D | E | G | J |
| L | M | Q |
 .写出一个能表示元素G、J非金属性强弱关系的化学方程式H2S+Cl2=2HCl+S↓或Na2S+Cl2=2NaCl+S↓.
.写出一个能表示元素G、J非金属性强弱关系的化学方程式H2S+Cl2=2HCl+S↓或Na2S+Cl2=2NaCl+S↓.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1标准大气压下原子数为NA的水蒸气为1mol | |
| B. | 1L1mol/L的NaOH溶液中Na+的物质的量为1mol | |
| C. | 标准状况下,22.4L氦气的质量为4g | |
| D. | 用含1molHCl的盐酸制取氯气,氯元素失去的电子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
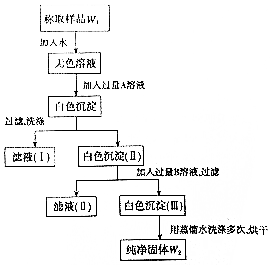 实验室有一瓶已部分被氧化的亚硫酸钠固体,为测定亚硫酸钠的质量分数,某同学设计如图所示实验.请根据实验步骤填写下列空白.
实验室有一瓶已部分被氧化的亚硫酸钠固体,为测定亚硫酸钠的质量分数,某同学设计如图所示实验.请根据实验步骤填写下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
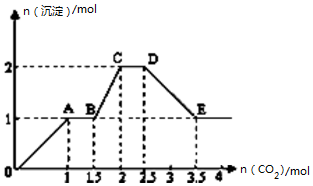 现有易溶强电解质的混合溶液10L,其中可能含存K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的是( )
现有易溶强电解质的混合溶液10L,其中可能含存K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的是( )| A. | 该溶液中能确定存在的离子是 Ba2+、AlO2-、NH4+ | |
| B. | 肯定不存在的离子是SO42-、OH- | |
| C. | 若不能确定的离子中至少还存在一种阳离子,则该离子的最小浓度为0.2mol/L | |
| D. | OA 段反应的离子方程式:2 AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 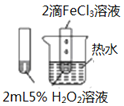 图验证FeCl3对H2O2分解反应有催化作用 | |
| B. | 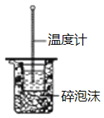 图用于中和热的测定 | |
| C. | 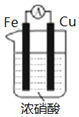 图用于探究Cu作负极的原电池原理 | |
| D. |  图用于比较盐酸、碳酸、硅酸的酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com