
| |||||||||||||||||||||||||||
科目:高中化学 来源: 题型:
 归纳整理是科学学习的重要方法之一.在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分).
归纳整理是科学学习的重要方法之一.在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分).| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | 217 | 450 |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | 450 | |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
查看答案和解析>>
科目:高中化学 来源: 题型:

请根据表回答下列问题:
(1)硒的熔点范围可能是_____________。
(2)碲的化合价可能有_____________。
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱顺序是_____________(填化学式)。
(4)氢硒酸有较强的(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为____________________________________。
(5)下图所示为氧族元素单质与H2反应过程中的能量变化(ΔH)示意图,其中a、b、c、d分别表示氧族中某一元素的单质,ΔH为相同物质的量的单质与H2反应的反应热。则:b代表___________(写单质名称)。
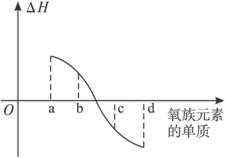
(6)硫的最高价含氧酸(H2SO4)是一种用途广泛的化学试剂。工业大量生产时通常要经过①含硫物质的氧化 ②SO2催化氧化成SO3 ③SO3的吸收三个主要过程。已知SO2的催化氧化是一个放热的可逆反应,该反应化学平衡常数(K)的表达式为_______________________,为提高SO2的转化率,试写出两种可以采用的措施:_____________________________;_______________________________。吸收SO3时若反应过快会形成酸雾,则是否可以用水直接吸收?________________________。
查看答案和解析>>
科目:高中化学 来源:2010年重庆市南开中学高三10月月考(理综)化学部分 题型:填空题
(16分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃ | —218。4 | 113 | | 450 |
| 单质沸点(℃) | —183 | 444.6 | 685 | 1390 |
| 主要化合价 | —2 | —2,+4,+6 | —2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | 450 | |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com