
【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是![]() ,并含少量的
,并含少量的![]() 、
、![]() 、MgO、CaO等,生产工艺流程图如下:
、MgO、CaO等,生产工艺流程图如下:
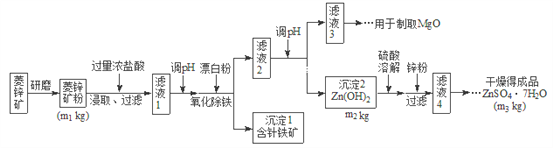
(1)将菱锌矿研磨成粉的目的是_______________。
(2)写出Fe3+水解的离子方程式_________________。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为__________。
沉淀化学式 |
|
|
|
|
开始沉淀的pH |
|
|
|
|
沉淀完全的pH |
|
|
|
|
开始溶解的pH |
|
|
|
|
Ksp |
|
|
|
|
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是________选填序号。
![]() 大理石粉
大理石粉 ![]() 石灰乳 c纯碱溶液 d氨水
石灰乳 c纯碱溶液 d氨水
(5)“滤液4”之后的操作依次为________、_______、过滤,洗涤,干燥。
(6)分析图中数据,菱锌矿粉中![]() 的质量分数不低于__________用代数式表示
的质量分数不低于__________用代数式表示
【答案】 增大反应物接触面积或增大反应速率或使反应更充分 Fe3++3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+ ![]() bd 蒸发浓缩 冷却结晶 125m2
bd 蒸发浓缩 冷却结晶 125m2![]() 1
1
【解析】考查化学工艺流程,(1)将棱锌矿研磨成粉的目的是增大反应物接触面积或增大反应速率或使反应更充分;(2)Fe3+为弱碱根离子,水解的离子方程式为Fe3++3H2O![]() Fe(OH)3+3H+;(3)滤液2中调节pH,得到滤液3和Zn(OH)2,即Mg2+不能出现沉淀,Zn(OH)2不溶解,因此pH的区间为
Fe(OH)3+3H+;(3)滤液2中调节pH,得到滤液3和Zn(OH)2,即Mg2+不能出现沉淀,Zn(OH)2不溶解,因此pH的区间为![]() ;(4)a、大理石不溶于水,无法让Mg2+转化成Mg(OH)2,故a错误;b、加入石灰乳,利用氢氧化镁比Ca(OH)2更难溶的性质,将Mg2+转化成Mg(OH)2,故b正确;c、纯碱与Mg2+反应生成MgCO3,MgCO3的溶解度大于Mg(OH)2,故c错误;d、Mg2+能够转化成Mg(OH)2,故d正确;(5)得到ZnSO4·7H2O,一般采用方法是蒸发浓缩、冷却结晶;(6)Zn(OH)2中锌的物质的量为m2×103/99mol,根据原子守恒,棱锌矿中锌原子物质的量至少为m2×103/99mol,即ZnCO3的物质的量至少为m2×103/99mol,即质量为125×m2×103/99g,质量分数为
;(4)a、大理石不溶于水,无法让Mg2+转化成Mg(OH)2,故a错误;b、加入石灰乳,利用氢氧化镁比Ca(OH)2更难溶的性质,将Mg2+转化成Mg(OH)2,故b正确;c、纯碱与Mg2+反应生成MgCO3,MgCO3的溶解度大于Mg(OH)2,故c错误;d、Mg2+能够转化成Mg(OH)2,故d正确;(5)得到ZnSO4·7H2O,一般采用方法是蒸发浓缩、冷却结晶;(6)Zn(OH)2中锌的物质的量为m2×103/99mol,根据原子守恒,棱锌矿中锌原子物质的量至少为m2×103/99mol,即ZnCO3的物质的量至少为m2×103/99mol,即质量为125×m2×103/99g,质量分数为![]() 2
2![]() 1。
1。


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:
【题目】在Fe、Cu、稀H2SO4组成的原电池中。下列叙述错误的是
A.电子流从铁棒经导线流入铜棒B.溶液逐步变为浅绿色
C.溶液的酸性减弱D.气泡在铁片上产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为________。
(2)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为__________。
(3)某结晶水合物的化学式为A·nH2O,A的相对分子质量为M。如将a g该化合物加热至结晶水全部失去,剩余的残渣为b g,则n=________。
(4)已知a g A和b g B恰好完全反应生成0.2 mol C和d g D,则C的摩尔质量为____________。
(5)在某温度下,NaOH的溶解度为20g,该温度下将80gNaOH投入220g水中,充分搅拌后,静置,测得溶液的密度为1.2g/mL,则该溶液中溶质的物质的量浓度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(NH2COONH4)是一种白色固体,可由两种常见气体制取,其易分解、易水解,可用于医药、氨化剂等。某科研小组利用以下装置制备氨基甲酸铵。回答下列问题:
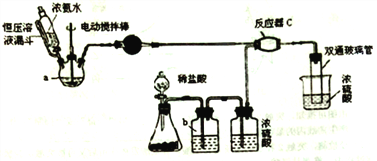
(1)写出a中的固体药品的名称________,制取氨气的原理为___________(结合化学方程式并用简要的文字加以说明)。
(2)恒压滴液漏斗的作用是________。
(3)有同学建议该CO2发生装置直接改用如下装置代替,你认为他的改进有何优点(试述一种): ________ 。
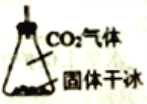
(4)反应器C中发生反应的化学方程式为________ 。
(5) 双通玻璃管的作用________;b中溶液的作用________ 。
(6)上述制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。
①设计方案,进行成分探究,请填写表中空格。
限选试剂: 蒸馏水、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、稀盐酸。
实验步骤
预期现象和结论
步骤1: 取少量固体样品于试管中,加入蒸馏水至固体溶解。
得到无色溶液
步骤2: 向试管中加入过量的BaCl2溶液,静置。
溶液不变浑浊,则证明固体中不含有________。
步骤3: 取步骤2的上层清液于试管中加入少量 的______。
溶液变浑浊,则证明固体中含有_______。
②根据①的结论: 取氨基甲酸铵样品15.80g,用上题步骤经充分处理后,过滤、洗涤、干燥,测得沉淀质量为5.91g 。则样品中氨基甲酸铵的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质,都能与Na反应放出H2,其产生H2的速率排列顺序正确的是( )
①C2H5OH ②稀盐酸 ③H2O
A.①>②>③B.②>①>③
C.③>①>②D.②>③>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)回答下列问题:已知反应①中相关的化学键键能数据如下:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=______kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=_______kJ·mol-1。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1 275.6 kJ·mol-1
②H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式_________________。
(3)已知常温时红磷比白磷稳定,已知:
①P4(白磷,s)+5O2(g)===2P2O5(s)ΔH1
②4P(红磷,s)+5O2(g)===2P2O5(s)ΔH2
比较反应中ΔH的大小:ΔH1_______ΔH2(填“>”、“<”或“=”)。
(4)已知:稀溶液中,H+(aq)+OH﹣(aq)===H2O(l)ΔH=﹣57.3 kJ![]() ,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量_____57.3 kJ(填“>”、“<”或“=”)。
,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量_____57.3 kJ(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下化学反应的产物种类与反应物的浓度、用量和反应条件均无关的是( )
A.NH3通入AlCl3溶液中
B.Cu与硝酸反应
C.CO2通入NaOH溶液中
D.Na与O2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为:
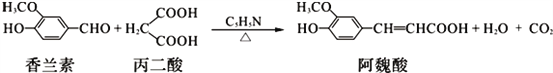
则下列说法不正确的是( )
A. 丙二酸与乙二酸(HOOC—COOH)互为同系物
B. 由题中信息可知阿魏酸的分子式为C10H12O4
C. 香兰素、阿魏酸都是芳香族化合物
D. 阿魏酸分子最多有10个碳原子共平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com