
分析 反应自发进行的判断依据是△H-T△S<0,依据热化学方程式焓变、熵变、温度分析判断.
解答 解:常温常压下,T=298K
(1)2KClO3(s)═2KCl(s)+3O2(g)△H=-78.03kJ•mol-1△S=+494.4J•mol-1•K-1,△H-T△S=-78.03kJ•mol-1-298×0.4944KJ•mol-1•K-1=-225.3KJ/mol<0,反应自发进行,故(1)正确;
(2)CO(g)═C(s,石墨)+$\frac{1}{2}$O2(g)△H=+110.5kJ•mol-1△S=-89.36J•mol-1•K-1,△H-T△S=110.5kJ•mol-1-298K×(-0.089.36KJ•mol-1•K-1)>0,反应一定非自发进行,故(2)错误;
(3)4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H=-444.3kJ•mol-1△S=-280.1J•mol-1•K-1 ,△H-T△S=-444.3kJ•mol-1-298K×(-0.2801KJ•mol-1•K-1 )=-360.8KJ/mol<0,反应自发进行,故(3)正确;
(4)CaCO3(s)═CaO(s)+CO2(g)△H=+178.2kJ•mol-1△S=+169.6J•mol-1•K-1,△H-T△S=178.2kJ•mol-1-298K×0.1696KJ•mol-1•K-1=127.7KJ/mol>0,故(4)错误;
故答案为:(1)(3).
点评 本题考查了反应自发进行的判断依据,依据焓变、熵变、温度的计算是解题关键,题目较简单.


科目:高中化学 来源: 题型:多选题
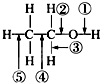 乙醇分子中的各种化学键如图所示,下列关于乙醇在各种反应中断裂键的说明不正确的是( )
乙醇分子中的各种化学键如图所示,下列关于乙醇在各种反应中断裂键的说明不正确的是( )| A. | 和金属钠反应时①键断裂 | |
| B. | 和乙酸发生酯化反应时②键断裂 | |
| C. | 在铜催化及加热条件下与O2反应时断裂①键和⑤键 | |
| D. | 在空气中完全燃烧时断裂①②③④⑤键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过足量的NaOH溶液 | B. | 通过足量的溴水 | ||
| C. | 在Ni催化、加热条件下通入H2 | D. | 通过足量的酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- | |
| B. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:Na+、CO32-、NO3-、AlO2- | |
| C. | 无色溶液中:K+、AlO2-、HCO3-、Cr2O72- | |
| D. | pH=1的溶液中:Na+、Al3+、NO3-、S2O32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M的相对原子质量为32 | B. | M的相对原子质量为64 | ||
| C. | 电解过程中溶液的pH不发生变化 | D. | 电路中通过0.05mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com