
在冶金工业上,均不能用通常化学还原剂制得的金属组是( )
A.Na,Mg,Al B.Na,K,Zn,Fe
C.Zn,Fe,Cu,Ag D.Mg,Al,Zn,Fe
科目:高中化学 来源: 题型:
某无色透明的混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此混合气体通过品红溶液后,品红溶液褪色,向剩余气体中通入空气,很快变为红棕色。 下列对于原混合气体成分的判断中正确的是( )
下列对于原混合气体成分的判断中正确的是( )
A.肯定没有SO2和NO B.肯定没有Cl2、O2和NO2
C.可能有 Cl2和O2 D.肯定只有NO
Cl2和O2 D.肯定只有NO
查看答案和解析>>
科目:高中化学 来源: 题型:
制备干燥氨气所需的药品是( )
A.NH4Cl溶液,NaOH溶液,熟石灰
B.饱和氨水
C.NaOH溶液,NH4Cl晶体,浓硫酸
D.NH4Cl固体,碱石灰,消石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质应用的说法错误的是
A.玻璃容器可长期盛放各种酸 B.纯碱可用于清洗油污
C.浓氨水可检验氯气管道漏气 D.Na2S可除去污水中的Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研
人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
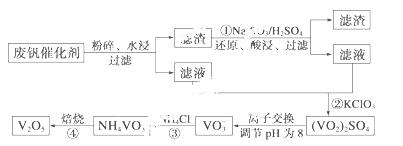
部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
回答下列问题:
(1)工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式 。
(2)图中所示滤液中含钒的主要成分为 (写化学式)。
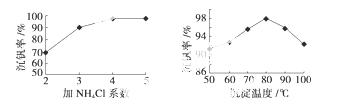
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式 ;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为 、 。
(4)用硫酸酸化的H2C2O4溶液滴定(V O2)2SO4溶液,以测定反应②后溶液中含钒量,
O2)2SO4溶液,以测定反应②后溶液中含钒量, 完成反应的离子方程式为□VO2++□H2C2O4+□_____ =□VO2++□CO2↑+□H2O。
完成反应的离子方程式为□VO2++□H2C2O4+□_____ =□VO2++□CO2↑+□H2O。
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+ 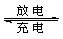 VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
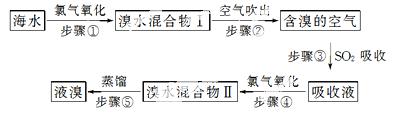
(1)步骤③的离子方程式:____________________________________________。
(2)步骤⑤中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是__________。
(3)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过__________(填试剂名称)溶液,以除去氯气。
(4)步骤⑤的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,
请解释原因:________________________________________________________。
(5)步骤①中用硫酸酸化可提高Cl 2的利用率,理由是____________________________________。
2的利用率,理由是____________________________________。
(6)提取溴单质,采用蒸馏“溴水混合物Ⅱ”而不是蒸馏“溴水混合物Ⅰ”,
请说明原因:_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向NaBr和KI混合溶液中通入足量Cl2后,将溶液蒸干并灼烧,最后得到的物质是( )
A.NaBr和KI B.NaBr和KCl
C.NaCl和KCl D.NaCl、KCl和I2
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:
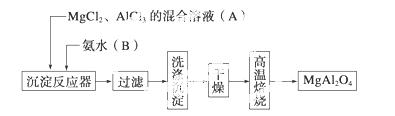
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
(2)无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
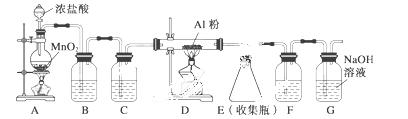
装置B中盛放饱和NaCl溶液,该装置的主要作用是______________。F中试剂的作用是________________。用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com