
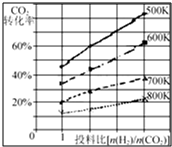
 在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:
在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
分析 (1)利用盖斯定律通过①×2+②+2×③计算化学反应的焓变即可;
(2)温度、体积不变的可逆反应中,气体的压强之比等于其物质的量之比,据此计算反应后气体体积的物质的量,从而计算CO反应的物质的量,根据CO反应的物质的量计算其转化率,转化率=$\frac{消耗量}{起始量}$×100%;
(3)根据图象可知,[n(H2)/n(CO2)]越大,CO2的转化率越大,温度越高,CO2的转化率小,且图中不同温度线的斜率不同,据此答题;
(4)根据平衡移动的影响因素判断;
(5)根据元素守恒可写出化学方程式,根据硫酸的性质分析该工艺的缺点;
解答 解:(1)①2H2(g)+CO(g)?CH3OH(g)△H=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
由盖斯定律可知,通过①×2+②+2×③可得所求反应方程式,则△H=2△H1+△H2-2△H3;
故答案为:2△H1+△H2-2△H3;
(2)温度、体积不变的可逆反应中,气体的压强之比等于其物质的量之比,15min,压强比(P后/P前)=0.80,则反应后气体的物质的量=3mol×0.80=2.40mol,气体减少的物质的量=3mol-2.4mol=0.6mol,根据气体减少的物质的量与CO之间的关系式知参加反应的CO的物质的量$\frac{0.9mol}{2}$=0.45mol,则CO的转化率=$\frac{0.45mol}{1mol}$×100%=45%,
故答案为:45%;
(3)根据图象可知,[n(H2)/n(CO2)]越大,CO2的转化率越大,温度越高,CO2的转化率小,且图中不同温度线的斜率不同,温度越低,增大投料比使CO2的转化率增大的越显著,
故答案为:升高温度,CO2的转化率降低;温度越低,增大投料比使CO2的转化率增大的越显著;
(4)根据平衡移动的影响因素可知,为提高CO2的转化率,可以将水蒸汽液化移去(或移去产物),
故答案为:将水蒸汽液化移去(或移去产物);
(5)根据元素守恒可知硫酸氢甲酯再和甲醇反应生成二甲醚的化学方程式为CH3OSO3H+CH3OH→CH3OCH3+H2SO4,该反应有硫酸参加,因为硫酸是强酸,具有较强的腐蚀性,能腐蚀设备,所以根据硫酸的性质可知该工艺的缺点是浓H2SO4腐蚀设备或有硫酸废液产生,
故答案为:CH3OSO3H+CH3OH→CH3OCH3+H2SO4;浓H2SO4腐蚀设备或有硫酸废液产生;
点评 本题考考查了热化学方程式和盖斯定律计算应用,转化率的计算及,影响平衡的因素分析判断,题目涉及的知识点较多,综合性较强,题目难度中等.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | XY2 | B. | X2Y3 | C. | X2Y | D. | XY |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
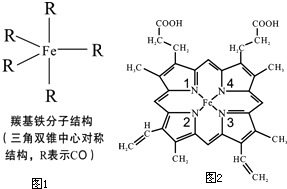 Fe、C、N、O、H可以组成多种物质.回答以下问题:
Fe、C、N、O、H可以组成多种物质.回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
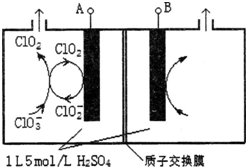 研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.
研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知磺酰氯(SO2Cl2)是一种有机氯化剂,SO2(g)+Cl2(g)=SO2C12(g)△H<0,SO2Cl2是一种无色液体,熔点-54.1℃,沸点69.1℃,极易水解,遇潮湿空气会产生白雾.
已知磺酰氯(SO2Cl2)是一种有机氯化剂,SO2(g)+Cl2(g)=SO2C12(g)△H<0,SO2Cl2是一种无色液体,熔点-54.1℃,沸点69.1℃,极易水解,遇潮湿空气会产生白雾.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com