
| A. | 甲烷的摩尔质量为16克 | |
| B. | 标准状况下,0.3molSO2中含氧原子数为0.3NA | |
| C. | 常温下,9.5克MgCl2晶体中含Mg2+为0.1 NA | |
| D. | 标准状况下,22.4L H2O含10 NA个电子 |
分析 A.摩尔质量单位为g/mol;
B.1个二氧化硫含有2个O;
C.依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算;
D.气体摩尔体积使用对象为气体.
解答 解:A.甲烷的摩尔质量为16g/mol,故A错误;
B.标准状况下,0.3molSO2中含氧原子数为0.3×2=0.6NA,故B错误;
C.常温下,9.5克MgCl2晶体中含Mg2+为:$\frac{9.5g}{95g/mol}$×1×NA=0.1 NA,故C正确;
D.标况下水是液态,不能使用气体摩尔体积,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积条件分析应用微粒个数计算,掌握基础是关键,题目较简单.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:解答题
 2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.
2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需的时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
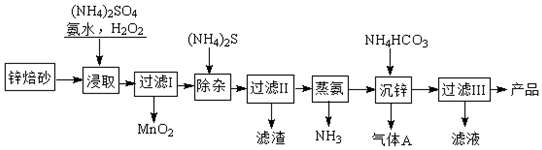
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CuO)(mol) | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{32p}{17}$ g/L | B. | $\frac{17p}{32}$ g/L | C. | $\frac{32}{17p}$ g/L | D. | $\frac{17}{32p}$ g/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 类别 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 苏打 | 纯净空气 | CaCO3 | 干冰 |
| B | 碘酒 | 漂白粉 | NH3•H20 | Fe |
| C | 明矾 | 铝合金 | 石墨 | 醋酸 |
| D | 盐酸 | CuSO4•5H2O | Na2SO4 | 酒精 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com