
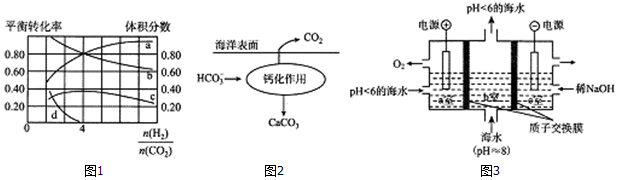
分析 (1)已知:H2和CH4的燃烧热分别为-285.5kJ•mol-1和-890.0kJ•mol-1,可知热化学方程式
a.H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H=-285.5kJ•mol-1,
b.CH4(g)+2O2(g)=CO2(g)+2H2O(1)△H=-890.0kJ•mol-1,
c.H2O(1)═H2O(g)△H3=44.0kJ•mol-1,4a+2c-b得,CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H1=-164.0kJ•mol-1,据此进行分析;
(2)据平衡移动分析;催化剂能加快化学反应速率,故工业上提高甲烷反应透择性的关键因素是催化剂;
(3)反应物有两种以上的,增大一种反应物浓度可以提高另一种反应物的转化率,本身转化率降低;由图可知,横坐标为$\frac{n({H}_{2})}{n(C{O}_{2})}$=4时,反应物的转化率为80%;据K=$\frac{{c}^{2}({H}_{2}O)c(C{H}_{4})}{c(C{O}_{2}){c}^{4}({H}_{2})}$进行计算;
(4)由图可知:此过程碳酸氢根转化生成碳酸钙,据此书写方程式;
(5)a室为阳极,发生的电极反应为2H2O-4e-=O2↑+4H+,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变;其间b室发生反应的离子方程式为H++HCO3-=CO2↑+H2O,据此进行分析.
解答 解:(1)已知:H2和CH4的燃烧热分别为-285.5kJ•mol-1和-890.0kJ•mol-1,可知热化学方程式
a.H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H=-285.5kJ•mol-1,
b.CH4(g)+2O2(g)=CO2(g)+2H2O(1)△H=-890.0kJ•mol-1,
c.H2O(1)═H2O(g)△H3=44.0kJ•mol-1,4a+2c-b得,CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H1=-164.0kJ•mol-1,
故答案为:-164;
(2)CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H1=-164.0kJ•mol-1,有利于提高CH4平衡产率,即平衡正向移动,故条件是降低温度或增大压强;催化剂能加快化学反应速率,故工业上提高甲烷反应透择性的关键因素是催化剂,
故答案为:降低温度,增大压强;催化剂;
(3)反应物有两种以上的,增大一种反应物浓度可以提高另一种反应物的转化率,本身转化率降低,依据图象可知,b曲线为氢气转化率曲线;
由图可知,横坐标为$\frac{n({H}_{2})}{n(C{O}_{2})}$=4时,甲烷的体积分数最大;
由图象分析得a为CO2,b为H2,c为CH4,
CO2(g)+4H2(g)=CH4(g)+2H2O(g)
开始(c) 0.5 2 0 0
变化 0.4 1.6 0.4 0.8
平衡 0.1 0.4 0.4 0.8
K=$\frac{{c}^{2}({H}_{2}O)c(C{H}_{4})}{c(C{O}_{2}){c}^{4}({H}_{2})}$=$\frac{0.{8}^{2}×0.4}{0.1×0.{4}^{4}}$=100,
故答案为:b;4;100;
(4)反应物中含有碳酸氢根,生成物为碳酸钙,依据元素守恒以及电荷守恒得出方程式为:
2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O,
故答案为:2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O;
(5)a室为阳极,发生的电极反应为2H2O-4e-=O2↑+4H+,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变;其间b室发生反应的离子方程式为H++HCO3-=CO2↑+H2O,
故答案为:几乎不变;H++HCO3-=CO2↑+H2O.
点评 本题考查反应热的计算,平衡的移动,平衡常数的计算,离子方程式的书写,以及利用电极方程式判断溶液pH的变化,本题难度中等.


科目:高中化学 来源: 题型:解答题
 研究CO2转化成有机物实现碳循环对实现社会的可持续发展具有重要的意义.将燃煤废气中的CO2转化为二甲醚的反应原理为2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(1).
研究CO2转化成有机物实现碳循环对实现社会的可持续发展具有重要的意义.将燃煤废气中的CO2转化为二甲醚的反应原理为2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(1).| 序号 | 起始投料量不同的压强下, 平衡CH3OCH3(g)的量不同的压强 | P1 | P2 | P3 |
| I | 2.0molCO2 6.0molH2 | 0.10mol | 0.04mol | 0.02mol |
| II | 1.0molCO2 3.0molH2 | X1 | Y1 | Z1 |
| III | 1.0mol CH3OCH3 3.0mol H2O | X2 | Y2 | Z2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质均由原子或分子构成 | |
| B. | 已知的大部分物质属于有机物 | |
| C. | 食品加工中应严禁使用人工合成的物质 | |
| D. | 干冰、可燃冰属于同种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10% | B. | 11.1% | C. | 0.1% | D. | 20% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L2mol•L-1K2S溶液中S2-和HS-的总数为2NA | |
| B. | 电解精炼铜时,若阴极得电子数为2NA,则阳极质量减少64g | |
| C. | 1mol聚苯乙烯分子有碳碳双键的数目为NA | |
| D. | 1molMg在空气中燃烧生成MgO(含少量Mg3N2)失去电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
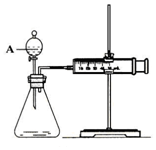 用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0,7克镁带,按图连接好装置,从A中加入20.0ml0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.记录数据如表
用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0,7克镁带,按图连接好装置,从A中加入20.0ml0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.记录数据如表| 时间/s | 0 | t | 2t | … |
| 活塞的位置/ml | 17.3 | 25.6 | 36.6 | … |
| 实验序号 | 双氧水体积/mL | 蒸馏水体积/mL | 添加的物质 |
| 1 | 10 | 0 | 4mLFeCl3 |
| 2 | 10 | 2 | 2mLCuCl2 |
 .
. | 0.1g | 0.3g | 0.8g |
| 10mL1.5% | 223s | 67s | 36s |
| 10mL3.0% | 308s | 109s | 98s |
| 10mL4.5% | 395s | 149s | 116s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
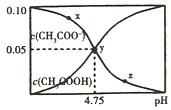 常温下,向1L 0.10mol/L CH3COONa溶液中,不断通入HCl气体(忽略溶液体积变化),得到c(CH3COO-)和c(CH3COOH)与pH的变化关系如图,则下列说法不正确的是( )
常温下,向1L 0.10mol/L CH3COONa溶液中,不断通入HCl气体(忽略溶液体积变化),得到c(CH3COO-)和c(CH3COOH)与pH的变化关系如图,则下列说法不正确的是( )| A. | 溶液的pH比较:x>y>z | |
| B. | 在y点再通入0.05molHCl气体,溶液中离子浓度大小比较:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| C. | 在溶液中加入一滴强酸或强碱,溶液pH变化最小的是y点 | |
| D. | 该温度下,CH3COONa的Kb=10-4.75 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com